1、填空题 化学实验中,如使某步中的有害产物作为另一步的反应物,形成一个循环,就可不再向环境排放该种有害物质。例如:
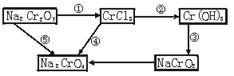
(1)在上述有编号的步骤中,需用还原剂的是___________,需用氧化剂的是___________ (填编号)。
(2)在上述循环中,既能与强酸反应又能与强碱反应的两性物质是___________(填化学式)。
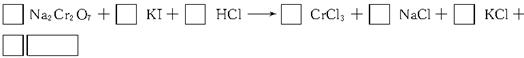
(3)完成并配平步骤①的化学方程式,标出电子转移的方向和数目:
参考答案:(1)①?④
(2)Cr(OH)3
(3)1? 6? 14? 2? 2? 6? 3 ?7? H2O
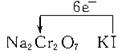
本题解析:(1)在①变化中,Cr元素由+7价变为+3价,化合价降低,需还原剂;②③两步变化中Cr元素的价态都是+3价,⑤步变化中Cr元素的价态都是+7价,②③⑤都是非氧化还原反应;在④步变化中,Cr元素由+3价变为+7价,化合价升高,需要氧化剂。
(2)Cr(OH)3既能与盐酸反应生成CrCl3,又能与NaOH反应生成NaCrO2,为两性氢氧化物。
(3)此小题考查了化学方程式的配平方法。先找出该反应的氧化剂、还原剂及氧化产物、还原产物,并配出其化学计量数;再由原子守恒配出NaCl、KCl的计量数,最后补充H2O,并配平其计量数。
本题难度:简单
2、填空题 (5分)利用氧化还原反应原理配平以下化学方程式,并填空:
FeSO4 + KNO3 + H2SO4 === K2SO4 + Fe2(SO4)3 + NO↑+ H2O
①氧化产物为
②当电子转移了0.3mol时,有 g氧化剂参加反应
参考答案:6 FeSO4 + 2KNO3 + 4H2SO4 === 1K2SO4 + 3Fe2(SO4)3 + 2NO↑+ 4H2O(2分)
①Fe2(SO4)3(1分) ②10.1(2分)
本题解析:氧化还原反应中电子得失是守恒的,据此可以配平。根据方程式可知铁的化合价升高1个单位,硝酸钾中氮元素的化合价降低3个单位,即还原剂和氧化剂的个数之比是3
本题难度:一般
3、填空题 已知硫酸锰(MnSO4)和过硫酸钾(K2S2O8)两种盐溶液在催化剂作用下可发生氧化还原反应,生成高锰酸钾、硫酸钾和硫酸
(1)完成反应的化学方程式,并表示电子转移的方向和数目
____MnSO4+_____K2S2O8+_______=____KMnO4+_____K2SO4+_______H2SO4
(2)此反应的还原产物是________,当生成1mol高锰酸钾时,共有________mol电子转移
参考答案:(1)2MnSO4+5K2S2O8+8H2O=2KMnO4+4K2SO4+8H2SO4(单线桥表示法“略”)(2)K2SO4和H2SO4;5
本题解析:
本题难度:一般
4、选择题 向50mL 18mol/L浓硫酸溶液中加入足量铜片并加热,充分反应后,被还原的浓硫酸的物质的量是(?)
A.小于0.45 mol
B.等于0.45mol
C.大于0.45mol
D.在0.45mol和0.9mol之间
参考答案:A
本题解析:浓硫酸再和铜的反应过程中,浓硫酸的浓度逐渐降低。而稀硫酸与铜是不反应的,所以根据反应的化学方程式Cu+2H2SO4(浓) CuSO4+2H2O+SO2↑可知,被还原硫酸的物质的量小于0.05L×18mol/L÷2=0.45mol,答案选A。
CuSO4+2H2O+SO2↑可知,被还原硫酸的物质的量小于0.05L×18mol/L÷2=0.45mol,答案选A。
点评:该题是高考中的常见题型,属于中等难度的试题。试题基础性强,难易适中,贴近高考。该题的关键是明确稀硫酸与浓硫酸的性质差异,然后结合题意灵活运用即可,有利于培养学生的逻辑推理能力和发散思维能力,提高学生灵活运用知识解决实际问题的能力。
本题难度:一般
5、简答题 向盛有KI溶液的试管中加入少许CCl4后滴加氯水,CCl4层变成紫色。如果继续向试管中滴加氯水,振荡,CCl4层会逐渐变浅,最后变成无色。
完成下列填空:
1) 写出并配平CCl4层由紫色变成无色的化 学反应方程式(如果系数是1,不用填写):
学反应方程式(如果系数是1,不用填写):

写出产物即可不需要配平
2)整个过程中的还原剂是 。
3)把KI换成KBr,则CCl4层变为 色:继续滴加氯水,CCl4层的颜色没有变化。由此推测 、
、 、
、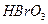 氧化性由强到弱的顺序是 。
氧化性由强到弱的顺序是 。
参考答案:
 (写出产物即可,不需要配平)
(写出产物即可,不需要配平)
(2)还原剂是 I2 。
(3) 棕色 色:氧化性由强到弱的顺序是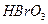 >
> >
>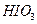 。
。
本题解析:略
本题难度:一般