1、简答题 向盛有KI溶液的试管中加入少许CCl4后滴加氯水,CCl4层变成紫色。如果继续向试管中滴加氯水,振荡,CCl4层会逐渐变浅,最后变成无色。
完成下列填空:
1) 写出并配平CCl4层由紫色变成无色的化 学反应方程式(如果系数是1,不用填写):
学反应方程式(如果系数是1,不用填写):

写出产物即可不需要配平
2)整个过程中的还原剂是?。
3)把KI换成KBr,则CCl4层变为?色:继续滴加氯水,CCl4层的颜色没有变化。由此推测 、
、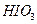 、
、 氧化性由强到弱的顺序是?。
氧化性由强到弱的顺序是?。
2、填空题 过量铁粉与稀硝酸反应的方程式为:
3Fe + 8HNO3 (稀)= 3Fe(NO3)?2 + 2NO↑ + 4H2O
①?标出电子转移的方向和数目
② 该反应的氧化剂是?,还原产物是?;
③ 标准状况下,当生成2.24L NO气体时, 有??g Fe参加反应,转移的电子总数为个,有?mol氧化剂被还原。
3、计算题 在50 mL a mol·L-1的硝酸溶液中,加入6.4g Cu,全部溶解,假设硝酸的还原产物只有NO2和NO,将反应后溶液用蒸馏水稀释至100 mL时测得c(NO3-)=3 mol·L-1。
(1)求稀释后的溶液中H+的物质的量浓度
(2)若a=9,求生成的气体中NO2的物质的量
(3)治理氮氧化物污染的方法之一是用NaOH溶液进行吸收,反应原理如下:
NO2+NO+2NaOH=2NaNO2+H2O、2NO2+2NaOH=NaNO2+NaNO3+H2O。若将上述的NO2和NO的混合气体通入1 mol·L-1的NaOH溶液恰好被吸收,求需要NaOH溶液的体积。
4、选择题 把图二的碎纸片补充到图一中,可得到一个完整的离子方程式。对该离子方程式的说 法正确的是

A.配平后的化学计量数依次为3、1、2、6、3
B.若有1 mol的S被氧化,可生成2 molS2-
C.氧化剂与还原剂的物质的量之比为1:2
D.2 mol S参加反应转移3 mol电子
5、填空题 交警常用“司机饮酒检测仪”检查司机是否酒后驾车,其原理是硫酸酸化的重铬酸盐(Cr2O72-橙红色)和乙醇反应生成铬盐(Cr3+绿色)和乙酸等。重铬酸钠(Na2Cr2O7)在工业中有很广泛的应用,常用来制备金属铬。方法如下:
将铬铁矿[主要成分Fe(CrO2)2]与纯碱、氧气高温焙烧,除杂、酸化,得到重铬酸钠,碳和重铬酸钠在高温下反应生成Cr2O3、Na2CO3和CO,Cr2O3再经铝热法还原,即可制得金属铬。请回答:
(1)硫酸酸化的K2Cr2O7和乙醇反应的化学方程式是 。
(2)写出碳和重铬酸钠高温反应的化学方程式 。
Cr2O3经铝热法还原制得金属铬的化学方程式是 。
(3)硫酸酸化的Na2Cr2O7和FeSO4反应,生成Cr3+等,该反应的离子方程式是 。
(4)某Na2Cr2O7样品2.00g恰好和4.56gFeSO4完全反应,该样品的纯度为 。