1、实验题 (10分)实验室利用如图装置进行中和热的测定。
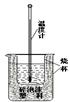
回答下列问题:①如图装置中,为了酸碱能更充分地反应,应该增加一个?(填玻璃仪器名称);大烧杯上没有盖上硬纸板,测得的中和热数值将会?(填“偏大”、“偏小”或“无影响”)。
②在操作正确的前提下提高中和热测定的准确性的关键是?( 填代号)
A.进行实验时的气温? B.装置的保温隔热效果? C.实验所用酸碱溶液的体积
③如果用0.5?mol/L的盐酸和氢氧化钠固体进行实验,则实验中所测出的“中和热”的数值将?(填“偏大”、“偏小”、“不变”);原因是?。?
2、选择题 下列关于化学反应与能量的说法正确的是(?)
A.化学反应中一定有物质变化但不一定有能量变化
B.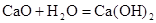 是放热反应,说明CaO的能量大于
是放热反应,说明CaO的能量大于 的能量
的能量
C.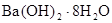 晶体与氯化铵晶体反应不需要加热就能发生,说明该反应是放热反应
晶体与氯化铵晶体反应不需要加热就能发生,说明该反应是放热反应
D.由H2→2H的过程需要吸收能量
3、选择题 1mol碳完全燃烧后可放出393.5KJ的热量,下列热化学方程式正确的是:?
A.C(s)+O2(g)=CO2(g);△H =" +393.5" kJ?mol-1
B.C(s)+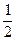 O2(g)=CO(g);△H = -393.5 kJ?mol-1
O2(g)=CO(g);△H = -393.5 kJ?mol-1
C.C+O2=CO2;△H = -393.5 kJ?mol-1
D.C(s)+O2(g)=CO2(g);△H = -393.5 kJ?mol-1
4、选择题 下列各组反应中,第一个反应放出的热量比第二个反应放出的热量多的是
(g、l、s分别表示气体、液体、固体)?(? )
A.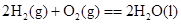
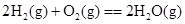
B.C(石墨)+O2(g)===CO2(g) C(金刚石)+O2(g)===CO2(g) (石墨比金刚石稳定)
C.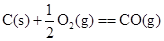
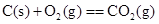
D.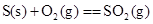
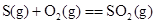
5、填空题 X、Y、Z、W均为10电子的分子或离子。X有5个原子核。通常状况下,W为无色液体。它们之间转化关系如图所示,请回答:
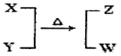
(1)工业上每制取1molZ要放出46.2 kJ的热量,写出该反应的热化学方程式:?。
(2)工业制取Z的化学平衡常数K与T的关系如下表:
T/K
| 298
| 398
| 498
| ……
|
K/(mol·L—1)—2
| 4.1×106
| K1
| K2
| ……
|
?
请完成下列问题:
①试比较K1、K2的大小,K1??K2(填写“>”“=”或“<”)
②恒温固定体积的容器中,下列各项能作为判断该反应达到化学平衡状态的依据的是 ?(填序号字母)。
A.容器内各物质的浓度之比为化学计量数比
B.混合气体密度保持不变
C.容器内压强保持不变
D.混合气体相对分子质量保持不变
(3)某化学小组同学模拟工业生产制取HNO3,设计下图所示装置,其中a为一个可持续鼓入空气的橡皮球。
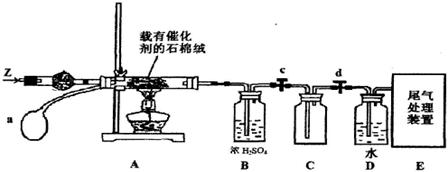
①A中发生反应的化学方程式是?。
②B中浓H2SO4的作用是?。
(4)写出D装置中反应的化学方程式?。
(5)a中通入空气的作用?。