1、实验题 实验室用50 mL 0.50 mol·L-1盐酸、50 mL 0.55 mol·L-1 NaOH溶液和下图所示装置进行测定中和热的实验,得到表中的数据:
实验次数
| 起始温度t1/℃
| 终止温度t2/℃
|
盐酸
| NaOH溶液
|
1
| 20.2
| 20.3
| 23.7
|
2
| 20.3
| 20.5
| 23.8
|
3
| 21.5
| 21.6
| 24.9
|
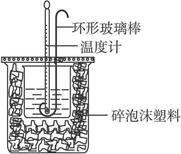
试完成下列问题:
(1)实验时用环形玻璃棒搅拌溶液的方法是_____________________________________,
不能用铜丝搅拌棒代替环形玻璃棒的理由是__________________________________。
(2)经数据处理,t2-t1="3.4" ℃。则该实验测得的中和热ΔH=_________〔盐酸和NaOH溶液的密度按1 g·cm-3计算,反应后混合溶液的比热容(c)按4.18 J·(g·℃)-1计算〕。
(3)若将NaOH溶液改为相同体积、相同浓度的氨水,测得中和热为ΔH1,则ΔH1与ΔH的关系为:ΔH1_________ΔH(填“<”“>”或“=”=,理由是________________________。
2、选择题 已知热化学方程式:
① C2H2(g) +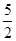 O2(g) ="=" 2CO2(g)+H2O(l)? ΔH1=-1301.0 kJ?mol-1
O2(g) ="=" 2CO2(g)+H2O(l)? ΔH1=-1301.0 kJ?mol-1
② C(s)+ O2(g) ="=" CO2(g)?△H2=-393.5 kJ?mol-1
③ H2(g)+ O2(g) ="=" H2O(1)?△H3 =" -285.8" kJ·mol-1
则反应④ 2C(s)+ H2(g) ="=" C2H2(g)的△H为
A.+228.2 kJ·mol-1
B.-228.2 kJ·mol-1
C.+1301.0 kJ·mol-1
D.+621.7 kJ·mol-1
3、填空题 (6分)依据事实,写出下列反应的热化学方程式。
(1)在25℃、101kPa下,1g乙醇燃烧生成CO2和液态水时放热29.7kJ。则表示乙醇燃烧热的热化学方程式为_____________________________。
(2)若适量的N2和O2完全反应,每生成23g NO2需要吸收16.95kJ热
量_________________________________。
(3)已知拆开1mol H-H键,1molN-H键,1molN≡N键分别需要的能量是436kJ、391kJ、946kJ,则N2与H2反应生成NH3的热化学方程式为________________________________
4、选择题 已知反应X+Y= M+N为吸热反应,对这个反应的下列说法中正确的是(?)
A.X的能量一定低于M的,Y的能量一定低于N的
B.因为该反应为吸热反应,故一定要加热反应才能进行
C.该化学反应进行时,只有能量被吸收,故为吸热反应
D.X和Y的总能量一定低于M和N的总能量
5、选择题 释放或吸收热量是化学反应中能量变化的主要形式之一。则下列有关说法不正确的是
A.生命体中糖类与氧气的反应、生产和生活中燃料的燃烧等都是反应热效应的重要应用
B.能源是可以提供能量的自然资源,包括化石燃料、阳光、风力、流水、潮汐等
C.一个化学反应是吸收能量还是放出能量,取决于反应物总能量和生成物总能量的相对大小
D.在化学反应过程中,只要反应物和生成物具有相同温度,反应所吸收或放出的热量就称为化学反应的焓变