1、选择题 在盛有稀H2SO4的烧杯中放入用导线连接的锌片和铜片,下列叙述正确的是
A.正极附近SO42-浓度逐渐增大
B.电子通过导线由铜片流向锌片
C.正极反应式为Zn-2e-=Zn2+
D.该原电池工作过程中电解质溶液的pH增大
参考答案:D
本题解析:负极生成Zn2+,SO42-向负极迁移,A错误;电子通过导线由锌片流向铜片,B错误;C中是负极反应式,C错误;随着硫酸的消耗,溶液的pH增大,D正确。
本题难度:一般
2、选择题 某原电池的总反应的离子方程式是:Zn+Cu2+=Zn2++Cu ,此反应原电池的正确组成是
[? ]
正极
负极
电解质溶液
A.
Cu
Zn
HCl
B.
Zn
Cu
CuS04
C.
Cu
Zn
CuS04
D.
Cu
Zn
ZnCl2
参考答案:C
本题解析:
本题难度:简单
3、填空题 有如图装置:回答下列问题:
(1)装置A是______池,B是______池.
(2)装置A中的Zn极是______极,Cu极上的电极反应方程式为:______.
(3)装置B中是浓度均为0.1mol/L的NaCl、CuSO4混合溶液,溶液体积为500mL,M、N均为石墨电极,当装置A中Zn棒质量减少32.5g时,N上质量增加______g;
(4)欲用装置B给用来给餐具镀银,N应该是______?(填“银”或“餐具”),电镀液的主要成分是(填化学式)______.
参考答案:(1)A能自发的进行氧化还原反应而作原电池,B连接外接电源属于电解池,
故答案为:原电;电解;
(2)原电池中,易失电子的金属锌作负极,铜作正极,正极上氢离子得电子发生还原反应而生成氢气,电极反应式为:2H++2e-=H2↑,
故答案为:负;2H++2e-=H2↑;
(3)M作阳极,N作阴极,电解氯化钠和硫酸铜混合溶液时,阳极上氯离子放电生成氯气,阴极上铜离子放电生成铜,串联电路中转移电子数相等,所以32.5g65g/mol×64g/mol=32g,故答案为:32;
(4)电镀时,镀层作阳极,镀件作阴极,电解质溶液中含有与镀层金属相同的金属阳离子,欲用装置B给用来给餐具镀银,N应该是餐具,电解质溶液是可溶性的AgNO3溶液,
故答案为:餐具;AgNO3.
本题解析:
本题难度:一般
4、选择题 在理论上不能用于设计原电池的化学反应是(?)
A.H2SO4+BaCl2==2HCl+BaSO4↓
B.2CH3CH2OH+3O2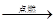 2CO2+4H2O
2CO2+4H2O
C.4Fe(OH)2+2H2O+O2==4Fe(OH)3
D.3Cu+8HNO3==3Cu(NO3)2+2NO↑+4H2O
参考答案:A
本题解析:由于电子的定向运动形成电流,所以只有氧化还原反应才能形成原电池,选项A是非氧化还原反应,所以正确的答案是A。
本题难度:简单
5、选择题 铅蓄可充电电池在现代生活中有广泛应用,它的充放电反应按下式进行:2PbSO4+2H2O═Pb+PbO2+2H2SO4,下列判断不正确的是( )
A.其充电过程作为电解池,放电过程作为原电池
B.放电时,Pb作为负极
C.放电时,PbO2发生还原反应
D.充电时,PbSO4在阴极转化为PbO2
参考答案:A:铅蓄可充电电池,充电过程是把电能转化成化学能,是电解池;放电过程是把化学能转变为电能,是原电池,故A对.
B:铅蓄可充电电池,放电时是原电池,其反应式为:Pb+PbO2+2H2SO4═2PbSO4+2H2O,Pb发生氧化反应,作负极,故B对.
C:铅蓄可充电电池,放电时是原电池,其反应式为:Pb+PbO2+2H2SO4═2PbSO4+2H2O,PbO2中Pb元素化合价降低,发生还原反应,故C对.
D:铅蓄可充电电池,充电时是电解池,其反应式为:2PbSO4+2H2O═Pb+PbO2+2H2SO4,阴极发生还原反应,PbSO4在阴极转化为Pb,故D错.
故选D.
本题解析:
本题难度:简单