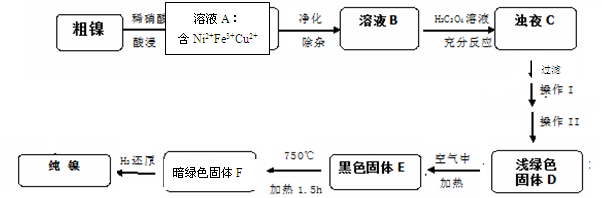
1、填空题 (14分)镍是一种十分重要的有色金属,但粗镍中一般含有Fe、Cu及难与酸、碱溶液反应的不溶性杂质而影响使用。现对粗镍进行提纯,具体的反应流程如下:
已知:
①2Ni2O3(黑色) 4NiO(暗绿色) + O2↑
4NiO(暗绿色) + O2↑
②
物质
| CuS
| Cu(OH)2
| Ni(OH)2
| NiS
|
Ksp
| 8.8×10-36
| 2.2×10-20
| 5.48×10-16
| 3.2×10-19
|
?
根据信息回答:?
(1)28Ni在周期表中的第?周期;镍与稀硝酸反应的离子方程式为?。实验表明镍的浸出率与温度有关,随 www.91eXam.org着温度升高镍的浸出率增大,但当温度高于70℃ 时,镍的浸出率又降低,浸出渣中Ni(OH)2含量增大,其原因为?;
(2)在溶液A的净化除杂中,首先将溶液A煮沸,调节PH=5.5,加热煮沸5min,静置一段时间后,过滤出Fe(OH)3。为了得到纯净的溶液B还需要加入以下物质?进行除杂(填正确答案标号)。
A、NaOH? B、Na2S? C、H2S? D、NH3﹒H2O
(3)已知以下三种物质的溶解度关系:NiC2O4>NiC2O4·H2O> NiC2O4·2H2O。则操作I、II名称是?、?; D生成E的化学方程式为??。
(4)1molE经上述流程得到纯镍,理论上参加反应的氢气为??mol。
(5)测定样品中的镍含量的基本思路是将Ni2+转化为沉淀,通过测量沉淀的质量进一步推算Ni含量。已知Ni2+能与CO32-,C2O42-、S2-等离子形成沉淀,但测定时常选用丁二酮肟(C4H8N2O2)作沉淀剂,生成分子式为C8H14N4O4Ni的鲜红色沉淀。从实验误差角度分析主要原因为:?。
参考答案:(除标注的空外,每空2分)
(1)四(1分);3Ni + 8H+ + 2NO3— = 3Ni2+ + 2NO↑+ 4H2O, 温度升高时,Ni2+的水解程度变大。
(2)C
(3)洗涤、干燥(各1分) 4NiC2O4·2H2O +3 O2= 2Ni2O3+ 8CO2↑ +8H2O
(4) 2
(5)生成沉淀质量大,称量误差小,分析结果准确度高。
本题解析:(1)28Ni核外有4层电子,是第四周期元素;根据流程图可知镍与稀硝酸反应生成硝酸镍和NO、水,离子方程式为3Ni + 8H+ + 2NO3— = 3Ni2+ + 2NO↑+ 4H2O;Ni(OH)2是由Ni2+水解而得到的,所以温度过高时Ni2+的水解程度变大,浸出渣中Ni(OH)2含量增大;
(2)AB选项中含有Na+,则溶液B中有Na+杂质,不纯净,错误;若选用D,则Cu(OH)2 Ni(OH)2的溶度积相差不大,而且引入NH4+,不易的纯净的硝酸镍溶液,错误;C、CuS与NiS的溶度积相差很大,Cu2+沉淀完全而且不会引入新的杂质,正确,答案选C;
(3)利用3种物质的溶解度的差异,浊液C中主要得NiC2O4·2H2O,所以沉淀过滤之后应洗涤、干燥沉淀;固体E为黑色,所以应是Ni2O3;则D生成E的化学方程式为4NiC2O4·2H2O +3 O2= 2Ni2O3+ 8CO2↑ +8H2O;
(4)1mol Ni2O3经上述流程转化为2molNiO,2molNiO与氢气发生氧化还原反应,生成单质镍,需要氢气的物质的量是2mol;
(5)因为Ni2+与丁二酮肟(C4H8N2O2)生成的C8H14N4O4Ni鲜红色沉淀的沉淀质量大,称量误差小,分析结果准确度高。
本题难度:一般
2、选择题 向含0.78molFeCl2溶液中通入0.09molCl2,再加入100mL1mol/L的X2O72-酸性溶液,使溶液中的Fe2+恰好全部氧化,则产物中X的化合价为
A.+1
B.+2
C.+3
D.+5
参考答案:C
本题解析:Fe2+-e-=Fe3+? Cl2-2e-=2Cl-
可见Fe2+共失去0.78mole-,氯气得到0.18mole-,0.1mol的X2O72-得到0.6mole-;而X2O72-中X的化合价为+6价,则可设产物中X的化合价为+n:0.1×2×(6—n)=0.6,得n=3,答案为C
本题难度:一般
3、简答题 配平下列化学方程式(将系数填在横线上),并写出还原剂.
______NH3+______O2═______NO+______H2O,此反应中的还原剂是______,此反应中电子转移的物质的量是______mol.
参考答案:反应中N元素化合价由NH3中-3价升高为NO中+2价,共升高5价,O元素由O2中0价降低为-2价,共降低4价,化合价升降最小公倍数为20,故NH3系数为4,故O2系数为5,利用元素守恒平衡可知NO系数为4,H2O的系数为6,故配平后方程式为:
4NH3+5O2═4NO+6H2O;
反应中N元素被氧化,NH3是还原剂;
转移电子的物质的量是NH3的5倍,故反应中转移的电子的物质的量为4mol×5=20mol.
故答案为:4、5、4、6;NH3;20.
本题解析:
本题难度:一般
4、选择题 含化合价为+5价的A元素的某氧化剂被亚硫酸钾还原,如果有0.003摩+5价的A元素被还原为较低价态,需用0.5mol/L的亚硫酸钾溶液15ml,则A元素被还原后的化合价是(?)
A.-2
B.0
C.+4
D.+2
参考答案:B
本题解析:亚硫酸钾的物质的量是0.0075mol,失去电子的物质的量是0.0075mol×2=0.015mol,所以根据电子的得失守恒可知,1molA得到的电子的物质的量是0.015÷0.003=5mol,所以A元素被还原后的价态是0价,答案选B。
本题难度:一般
5、选择题 高锰酸钾溶液在酸性条件下可以与硫酸亚铁反应,化学方程式如下(未配平):
?KMnO4+?FeSO4+?H2SO4=?K2SO4+?MnSO4+ ?Fe2(SO4)3+?H2O
下列说法正确的是
A.MnO4-是氧化剂,Fe3+是还原产物
B.Fe2+的还原性强于Mn2+
C.取反应后的溶液加KSCN溶液,可观察到有血红色沉淀生成
D.生成1mol水时,转移2.5mol电子
参考答案:B
本题解析:A、MnO4-是氧化剂,Fe3+是氧化产物,错误;B、还原剂还原性强于还原产物,正确;C、KSCN溶液与Fe3+反应生成配离子溶液,不是沉淀,错误;
D、? 2 KMnO4+? 10 FeSO4+? 8 H2SO4=? 1 K2SO4+? 2 MnSO4+ ?5 Fe2(SO4)3+ 8?H2O(反应有10个电子转移)计算生成1mol水时,转移10÷8=1.25mol电子,错误。
本题难度:一般