1、选择题 钾(K)与Na在性质上具有很大的相似性,但K比Na的活泼性强,下面是根据Na的性质对K的性质的预测,其中正确的是(? )
A.K的活泼性强,所以钾应该保存在煤油中
B.K在空气可以被空气中的氧气所氧化,且产物是K2O
C.K与水能够反应,但不如Na与水的反应剧烈,但产物都有氢气
D.K可以与水剧烈反应,生成氢气
参考答案:D
本题解析:A项中不仅考虑钾的活泼性,还应考虑单质钾的密度;B中常温下产生氧化钾,加热时产生过氧化钾,甚至超氧化钾;由于钾的活泼性强于钠,所以金属钾与水的反应较金属钠与水的反应剧烈。
本题难度:简单
2、选择题 某元素的单质与足量浓HNO3反应时,参加反应的单质与HNO3的物质的量之比为1∶4,则反应后的产物中,该元素的价态可能为?
A.+1
B.+5
C.+3
D.+4
参考答案:D
本题解析:浓硝酸的还原产物是NO2,转移的电子是1.根据得失电子守恒可知生成4mol还原产物转移4mol电子,所以1mol单质失去4mol电子,化合价是+4价,答案选D。
本题难度:一般
3、选择题 已知2Fe2++Br2=2Fe3++2Br-。向100mlFeBr2溶液中通入标准状况下的Cl2 3.36L,充分反应后测得溶液中Cl-与Br-的物质的量浓度相等,则原FeBr2溶液的物质的量浓度为
A.2mol/L
B.1mol/L
C.0.4mol/L
D.0.2mol/L
参考答案:A
本题解析:设原FeBr2溶液的物质的量为x。根据方程式可知,还原性是亚铁离子的强于溴离子的,因此氯气首先氧化亚铁离子。氯气是0.15nmol,根据电子的得失守恒可知,0.15mol×2=x+(2x-0.15mol×2),解得x=0.2mol,所以原FeBr2溶液的物质的量浓度为2.0mol/L,答案选A。
本题难度:一般
4、选择题 在碘酸钠(NaIO3)的碱性溶液中通入Cl2,可以得到高碘酸钠(Na2H3IO6).下列有关该反应的说法正确的是(?)
A.Cl2作还原剂
B.碱性条件下,NaIO3的氧化性强于Na2H3IO6
C.每生成1 mol Na2H3IO6,转移2 mol电子
D.氧化产物与还原产物的物质的量之比为2:1
参考答案:C
本题解析:A.反应中I元素化合价由NaIO3中+5价升高为Na2H3IO6中+7价,NaIO3是还原剂,Cl2作氧化剂,A错误;B.反应中I元素化合价由NaIO3中+5价升高为Na2H3IO6中+7价,NaIO3是还原剂,表现还原性,Na2H3IO6是氧化产物,Cl2作氧化剂,氧化性Cl2强于Na2H3IO6,B错误;C.反应中I元素化合价由NaIO3中+5价升高为Na2H3IO6中+7价,转移电子是Na2H3IO6的2倍,故生成1molNa2H3IO6,转移2mol电子,C正确;D.氧化产物为Na2H3IO6,还原产物为Cl-,根据电子转移守恒可知2n(Na2H3IO6)=n(Cl-),故n(Na2H3IO6):n(Cl-)=1:2,D错误;
选C.
本题难度:一般
5、填空题 (10分,每空2分)现有反应:①CO+CuO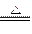 Cu+CO2 ?②MgO+2HCl====MgCl2+H2O
Cu+CO2 ?②MgO+2HCl====MgCl2+H2O
③Fe+2AgNO3====2Ag+Fe(NO3)2?④CH4+2O2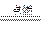 CO2+2H2O
CO2+2H2O
⑤NH4HCO3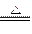 NH3↑+CO2↑+H2O
NH3↑+CO2↑+H2O
试完成:
(1)上述反应中属于置 换反应的有_____________。
换反应的有_____________。 属于复分解反应的有_____________。
属于复分解反应的有_____________。
(2)属于氧化还原反应的有_____________。
(3)反应③中被还原的元素是_____________。反应④中被氧化的元素是_____________。
参考答案:(10分,每空2分 )(1)③?②?(2)①③④?(3)银元素?碳元素
)(1)③?②?(2)①③④?(3)银元素?碳元素
本题解析:略
本题难度:一般