1、填空题 铝及其化合物在生产生活中具有重要的作用。
(1)铝在元素周期表中的位置是?。
(2)已知电负性的数值表示原子对电子吸引能力的相对大小。以下是几种原子的电负性数值:
?
①铝的电负性χ的范围是?。
②电负性的数值与元素金属性的关系是?。
③下列实验能比较镁和铝的金属性强弱的是?。
a.测定镁和铝的导电性强弱
b.测定等物质的量浓度的Al2(SO4)3和MgSO4溶液的pH
c.向0.1 mol/LAlCl3和0.1 mol/L MgCl2中加过量NaOH溶液
(3)铝热法是常用的金属冶炼方法之一。
已知:4Al(s)+3O2(g)=2Al2O3(s)?ΔH1=-3352 kJ/mol
Mn(s)+O2(g)=MnO2(s)?ΔH2= -521 kJ/mol
Al与MnO2反应冶炼金属Mn的热化学方程式是?。
(4)冶炼金属铝时,用石墨做电极电解熔融Al2O3。液态铝在(填“阴”或“阳”)?极得到,电解过程中,阳极石墨需要不断补充,结合电极反应说明其原因是?。
参考答案:(14分,每空2分)
(1)第3周期第ⅢA族
(2)①电负性数值越大,元素的金属性越弱
② 1.2<χ<1.8
③ c
(3)4Al(s)+ 3MnO2(s)=3Mn(s)+2Al2O3(s)? ΔH=–1789 kJ/mol
(4)阴
在阳极发生反应2O2-– 4e-=O2↑,C+O2=CO2,石墨由于被消耗需要不断补充
本题解析:(1)Al为13号元素,位于第3周期第ⅢA族。
(2)①根据电负性的变化规律,铝的电负性介于Mg和Si之间。
②电负性数值越大,原子对电子吸引能力越大,失电子越难,所以金属性越弱。
③a、导电性与电负性无关,错误;b、等物质的量浓度的Al2(SO4)3和MgSO4溶液,SO42?浓度不同,错误;c、加过量NaOH溶液,AlCl3溶液先出现沉淀后溶解,说明Al(OH)3呈两性,金属性弱于Mg,正确。
(3)首先写出化学方程式,注明状态,然后根据盖斯定律求焓变:?H=?H1–3?H2=" –1789" kJ?mol?1,进而写出热化学方程式。
(4)Al3+在阴极得电子生成Al;阳极O2?得电子生成O2,在较高温度下与石墨反应生成CO2,石墨电池被消耗,所以需要不断补充。
本题难度:困难
2、选择题 下列金属中,能与氢氧化钠溶液反应的是( )
A.铝
B.镁
C.铁
D.铜
参考答案:只有Al与NaOH溶液反应生成偏铝酸钠和氢气,而Mg、Fe、Cu均不与NaOH溶液反应,
故选A.
本题解析:
本题难度:一般
3、选择题 工业上用铝土矿(主要成分为Al2O3,含Fe2O3等杂质)为原料冶炼铝的工艺流程如下:
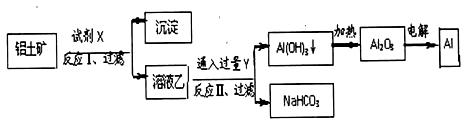
对上述流程中的判断不正确的是
A.试剂X为氢氧化钠溶液,试剂Y为CO2
B.结合质子(H+)的能力南强到弱的顺序是CO32->AlO2->OH
C.反应Ⅱ中生成Al(OH)3的反应为CO2+AlO2-+2H2O=Al(OH)3↓+HCO3-
D.Al2O3熔点很高,电解时向Al2O3中加入冰晶石,使Al2O3的熔点降低,从而减少冶炼过程中能量消耗。
参考答案:B
本题解析:略
本题难度:一般
4、填空题 (12分)已知铝土矿主要成分为Al2O3,还含有少量的Fe2O3、SiO2等杂质。下图是工业上冶炼铝的工艺流程图:
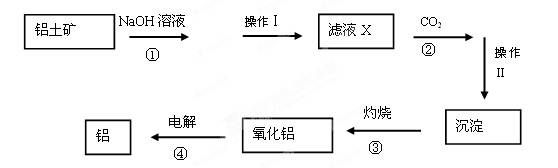
⑴操作Ⅰ和Ⅱ是用于分离溶液和沉淀,称为?。需要用到哪些玻璃仪器?
?
⑵操作Ⅰ分离出的沉淀除了含有泥沙外,一定还含有?,滤液X 中,含铝元素的溶质的化学式为?。写出步骤②中与过量CO2反应的化学方程式?
中,含铝元素的溶质的化学式为?。写出步骤②中与过量CO2反应的化学方程式?
⑶操作Ⅱ得到的 沉淀除了氢氧化铝还有?,它属于?(填“酸”、“碱”或“盐”)类物质。
沉淀除了氢氧化铝还有?,它属于?(填“酸”、“碱”或“盐”)类物质。
⑷实 验室里常往氯化铝溶液中加入?(填“氨水”或“NaOH溶液”),写出对应的离子方程式?
验室里常往氯化铝溶液中加入?(填“氨水”或“NaOH溶液”),写出对应的离子方程式?
参考答案:
⑵Fe2O3,(1分)NaAlO2,(1分) ?
NaAlO2+CO2+2H2O=Al(OH)3↓+NaHCO3(2分)
⑶硅酸或H2SiO3,酸(2分)
⑷氨水(1分),Al3++3NH3·H2O= Al(OH)3↓+3NH4Cl(2分)
本题解析:略
本题难度:一般
5、填空题 写出铝单质与强酸、强碱溶液反应的离子方程式,并标出电子转移的方向和数目:________、____ ____。日常生活中接触到的易拉罐有铁质和铝质之分,听装啤酒是铝质易拉罐,向一只充满二氧化碳气体的铝质易拉罐中加入适量的氢氧化钠溶液,并及时堵住,观察到的现象是____ ,用化学方程式表示产生这一现象的原因是___ 。若用薄铁质易拉罐做上述实验出现的结果是____。
参考答案: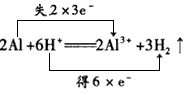 ;
;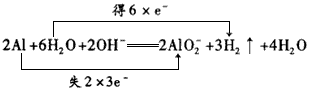 ;
;
易拉罐先瘪下去,一会儿又鼓起来 ;CO2+2NaOH=Na2CO3+H2O, 2Al+2H2O+2NaOH=2NaAlO2+3H2↑ ;薄铁质易拉罐瘪下去后,不再重新鼓起
本题解析:
本题难度:一般