1、选择题 下列说法正确的是
[? ]
A.Al2O3与水反应生成Al(OH)3
B.Al2O3熔点很高,可作耐火材料
C.Al(OH)3易溶于NaOH溶液和氨水中
D.Al(OH)3是白色胶状沉淀,是一种弱碱
参考答案:B
本题解析:
本题难度:简单
2、选择题 如图所示的实验中,投入铝片后?( )
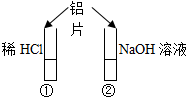
A.①中产生气泡,②中不产生气泡
B.①和②中都不产生气泡
C.①和②中都产生气泡,①中是H2,②中是O2
D.①和②中都产生气泡,且都是H2
参考答案:A、因②中发生2Al+2NaOH+2H2O=2NaAlO2 +3H2↑,则②中产生气泡,故A错误;
B、因①中发生2Al+6HCl=2AlCl3+3H2↑,②中发生2Al+2NaOH+2H2O=2NaAlO2 +3H2↑,则①和②中都产生气泡,故B错误;
C、因①中发生2Al+6HCl=2AlCl3+3H2↑,②中发生2Al+2NaOH+2H2O=2NaAlO2 +3H2↑,则都有气泡,且生成的都是H2,故C错误;
D、因①中发生2Al+6HCl=2AlCl3+3H2↑,②中发生2Al+2NaOH+2H2O=2NaAlO2 +3H2↑,则都有气泡,且生成的都是H2,故D正确;
故选D.
本题解析:
本题难度:简单
3、填空题 锂被誉为“高能金属”。工业上用硫酸与β-锂辉矿(LiAlSi2O6和少量钙镁杂质)在250~300℃反应,生成
Li2SO4以及硅铝化合物、MgSO4等,其工业生产流程如下
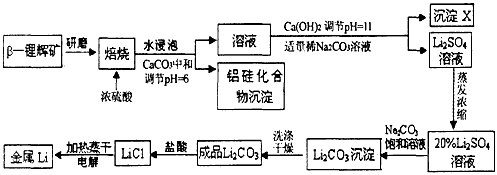
(1)用氧化物形式表示LiAlSi2O6的组成:___________________。
(2)沉淀X的主要成分是(写化学式)________________________。
(3)流程中两次使用了Na2CO3溶液,试说明前后浓度不同的原因________________。
(4)锂和氢气在加热时能反应生成白色固体氢化锂,氢化锂遇到水就立即溶解并释放出大量的气体。试写出氢化锂遇水反应的化学方程式:______________________。
(5)将盐酸与Li2CO3完全反应后的溶液,加热蒸干得到固体,再将其熔融电解生产锂。电解时产生的氯气中会混有少量氧气,原因是_____________________________。
参考答案:(1)Li2O·Al2O3·4SiO2
(2)CaCO3、Mg(OH)2
(3)前者是除去Ca2+,浓度过大会使部分Li+沉淀,后者是沉淀Li+,浓度大有利于Li2CO3沉淀的生成(其他合理答案均可)
(4)LiH+H2O==LiOH+H2↑
(5)加热蒸干LiCl溶液时,LiCl有少量水解生成LiOH,受热分解产成Li2O,电解时产生O2
本题解析:
本题难度:一般
4、填空题 (11分)铝土矿的主要成分是Al2O3,含有Fe2O3、SiO2等杂质,按下列操作从铝土矿中提取Al2O3。回答下列问题:
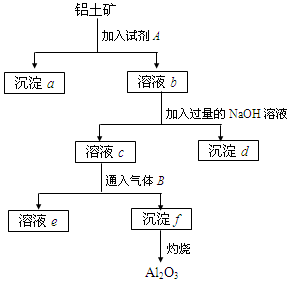
(1)沉淀物的化学式分别是:a?;d ??;f ?。
(2)溶液b中所含的金属阳离子是?;溶液c中所含的酸根离子是?。
(3)加入的试剂A是?,通入的气体B是?,能否将B换成A?其理由是?。
参考答案:(共11分) (1) SiO2? Fe(OH)3? Al(OH)3 ((3分)? (2)Al3+? Fe3+;AlO2-? Cl-(SO42-)(4分)? (3)盐酸? CO2?不行,A是强酸,如果过量会使Al(OH)3溶解( 4分)
本题解析:Al2O3、Fe2O3、SiO2三种物质分别为两性氧化物、碱性氧化物、酸性氧化物,可用酸或碱可以溶解其中两种。从后一步中加入过量的NaOH推知,第一步加入的是酸(盐酸或硫酸)。
本题难度:一般
5、选择题 向明矾溶液中滴入Ba(OH)2溶液,当SO42-恰好完全沉淀时,铝元素的存在形式是
A.一部分为Al(OH)3,一部分为Al3+
B.一部分为Al(OH)3,一部分为AlO2-
C.全部是Al(OH)3
D.全部是AlO2-
参考答案:D
本题解析:明矾的组成为KAl(SO4)2·12H2O,溶于水后:
KAl(SO4)2·12H2O=K++Al3+ + 2SO42-+12H2O
1mol? 1mol? 2mol
当使SO42-完全沉淀时,应加2mol Ba2+,即2mol Ba(OH)2,而2mol Ba(OH)2可产生4mol OH-。
2SO42-+2Ba2+=2BaSO4↓
Al3++4OH-=AlO2-+2H2O
可见当SO42-恰好沉淀完全时,Al(OH)3恰好完全消去,变成AlO2-。
本题难度:简单