1、简答题 实验室采用MgCl2、AlCl3的混合溶液与过量氨水反应制备MgAl2O4,主要流程如下
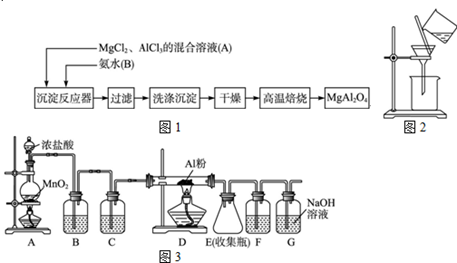
(1)为使Mg2+、Al3+同时生成沉淀,应先向沉淀反应器中加入??(填“A”“B”或),再滴加另一反应物。制备MgAl2O4过程中,高温焙烧时发生反应的化学方程式?。
(2)如下图所示,过滤操作中的一处错误是??。
(3)判断流程中沉淀是否洗净所用的试剂是??,高温焙烧时,用于盛放固体的仪器名称是??。
(4)无水AlCl3(183℃升华)遇潮湿空气即产生大量白雾,实验室可用下列装置制备。装置B中盛放饱和NaCl溶液,该装置的主要作用是?,F中试剂的作用是??。用一件仪器装填适当试剂后也可起到F和G的作用,所装填的试剂为??;
2、选择题 为测定某镁铝合金样品中铝的含量,进行下列实验:取一定量合金,加入100 mL 0.3 mol?L-1稀硫酸,合金完全溶解,产生的气体在标准状况下体积为560 mL;再加入0.2 mol?L-1 NaOH溶液至沉淀质量恰好不再变化,用去350 mL NaOH溶液。则所取样品中铝的物质的量为
A.0.005 mol
B.0.010 mol
C.0.020 mol
D.0.030 mol
3、选择题 下列有关金属及其合金的说法不正确的是
[? ]
A.目前我国流通的硬币是由合金材料制造的
B.生铁、普通钢和不锈钢中的碳含量依次增加
C.镁在空气中燃烧发出耀眼的白光,可用于制作照明弹
D.日用铝制品表面覆盖着氧化膜,对内部金属起保护作用
4、选择题 等体积的盐酸和氢氧化钠溶液分别与两份足量铝粉反应,在相同条件下产生相同体积的氢气。则盐酸和氢氧化钠溶液物质的量浓度之比为
A.1:1
B.2:1
C.3:1
D.2:3
5、填空题 将除去氧化膜的镁条插入到稀盐酸溶液中, 发现生成氢气的速度变化情况如下图所示: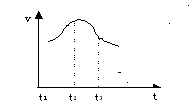
其中t1—t2速度变化的主要原因是
?
? t2—t3速度变化的主要原因是