1、填空题 锌和铝都是活泼金属,其氢氧化物既能溶于强酸,又能溶于强碱.但氢氧化铝不溶于氨水,而氢氧化锌能溶于氨水,生成[Zn(NH3)4]2+. 回答下列问题:
(1)单质铝溶于氢氧化钠溶液后,溶液中铝元素的存在形式为________(用化学式表示).
(2)写锌与强碱反应的化学方程式:______________________________________.
(3)下列各组中的两种溶液,用相互滴加的实验方法即可鉴别的是________.
①硫酸铝和氢氧化钠 ②硫酸铝和氨水 ③硫酸锌和氢氧化钠 ④硫酸锌和氨水
(4)写出可溶性铝盐与氨水反应的离子方程式:____________________.试解释在实验室不适宜用可溶性锌盐与氨水反应制备氢氧化锌的原因:_________________________.
参考答案:(1)AlO2-
(2)Zn+2NaOH===Na2ZnO2+H2↑
(3)①③④
(4)Al3++3NH3·H2O==Al(OH)3↓+3NH4+;可溶性锌盐与氨水反应产生的Zn(OH)2可溶于过量氨水中生成[Zn(NH3)4]2+,氨水的用量不易控制
本题解析:
本题难度:一般
2、填空题 22.(14分)我国的“神舟”系列载人飞船的成功发射,标志着“炎黄子孙千年飞天梦想实现了”。航天器的升空需要推进剂,推进剂主要由可燃剂和氧化剂组成,根据化学物质的形态不同推进剂可分为固体推进剂和液体推进剂,它们一般由C、H、O、N中的一种或几种元素组成。请回答下列问题:
(1)已知某固体推进剂主要由可燃剂(聚丁二烯等)和氧化剂甲(一种由三种元素组成的盐)组成,则甲的化学式为? ▲?,并用离子方程式表示甲的水溶液呈酸性的原因? ▲?。
(2)已知某液体推进剂主要由可燃剂乙和氧化剂丙组成,乙和丙常温下呈液态,它们均为氢化物(氢与其他元素形成的二元化合物)且分子中含有相同的电子数,常温下,乙和丙可生成一种常见的液态化合物和一种常见的稳定单质,试写出该反应的化学方程式? ▲?。另一种气态无色的氧化剂丁升温时(隔绝空气)迅速转化为红棕色气体,1mol乙在常温下与丁完全反应可放出Q kJ热量,产物与丙完全相同,试写出该反应的热化学方程式? ▲?。
A.石油产品? B.尿素? C.液氟?D.高氯酸铵
(4)戊也可作液体推进剂的氧化剂,取19.6g化合物戊,隔绝空气加热使其完全分解,生成氮气、氧气和二氧化碳,生成的氮气折合成标准状况下的体积为4.48L,生成的二氧化碳气体被足量的澄清石灰水吸收,得到10.0 g沉淀,则戊的化学式为? ▲??。
(5)请您设计一个实验方案,探究由上述四种元素组成的常见无机盐可能的成份? ▲??。
参考答案:(14分)
(1)NH4NO3(2分),NH4++H2O  H++NH3·H2O(2分)
H++NH3·H2O(2分)
(2)N2H4?+ 2H2O2?= N2+4 H2O(2分)
2N2H4(l)+ N2O4(g)=3 N2(g)+4 H2O(l)?△H=-2QkJ·mol-1(2分)
(3)B(2分)
(4)C(NO2)4(2分)
(5)无机盐可能是(NH4)2CO3或NH4HCO3或两者的混合物(1分),称量固体样品的质量mg,将样品加热,并将气体通入足量的澄清石灰水,测出沉淀的质量ng,通过m与n的计算获得最终结果。(1分)(其它合理答案也给分)
本题解析:略
本题难度:简单
3、选择题 下列化合物中,既能跟硫酸反应,又能跟氢氧化钠溶液反应的是(?)
①NaHCO3?②NaHSO4?③(NH4)2S?④NH3
A.只有①
B.只有①和④
C.除②外
D.全部
参考答案:C
本题解析:多元弱酸的酸式盐,既与强酸反应,又能与强碱反应,而NaHSO4只能与强碱反应,因此本题应选C。
本题难度:简单
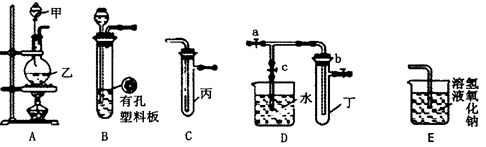
4、实验题 某化学兴趣小组的同学利用所示实验装置进行实验(图中a、b、c表示止水夹)。
请按要求填空:
(1)利用B装置可制取的气体有__________(填2种)。
(2)A、C、E相连后的装置可用于制取Cl2并进行相关的性质实验。若在丙中加入适量水,即可制得氯水。将所得氯水分成两份,进行Ⅰ、Ⅱ两个实验,实验操作、现象结论如下:

请你评价实验Ⅱ结论是否合理?_____________;理由:______________。
(3)请利用上述A、C装置设计一个简单的实验,验证Cl2和Br2的氧化性强弱(分别指出甲、乙、丙中盛装的试剂、实验现象及结论)_____________。
(4)B、D、E装置相连后,在B中盛装足量浓硝酸和铜片(放在有孔塑料板上),可制得NO2并进行有关实验。
①B中发生反应的化学方程式为____________________________。
②欲用D装置验证NO2与水的反应,其操作步骤为:先关闭止水夹a、b,再打开止水夹c,使烧杯中的水进入试管丁的操作是_______________________。
③试管丁中的NO2与一定量的O2混合充满后倒插水中,试管9/10充满水,则原试管丁中的混合气体平均相对分子质量可能为_________。(只填一种即可,保留二位小数)?
参考答案:(1)H2、CO2、H2S等;(2)不合理;因为制取的氯气中含有的HCl气体,HCl溶于水后也能与NaHCO3粉末反应产生气泡;(3)在甲、乙、丙中分别装入浓HCl、MnO2、NaBr溶液,烧瓶中有黄绿色气体生成,试管中溶液有无色变为橙色,证明Cl2的氧化性强于Br2;(4)Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O;双手握热试管丁,使2NO2与水接触; 42.08或44.04
本题解析:(1)利用该装置制取的气体应该是:块状固体和液体反应制取气体;反应不需要加热,制取的气体难溶解于水。可以制取H2、 CO2?、H2S等。(2)(2)不合理;因为制取的氯气中含有的HCl气体,HCl溶于水后也能与NaHCO3粉末反应产生气泡;应该先将HCl除去再进行实验就可以了。(3)氧化性强的能把氧化性弱的物质从它的化合物中置换出来。在甲、乙、丙中分别装入浓HCl、MnO2、NaBr溶液,烧瓶中有黄绿色气体生成,试管中溶液有无色变为橙色,证明Cl2的氧化性强于Br2;(4)①铜和浓硝酸反应的方程式是Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O; ②,使烧杯中的水进入试管丁的操作是双手握热试管丁,使2NO2与水接触;③剩余气体可能是O2也可能是NO。假设试管容积是10V,若剩余气体是O2。则根据4NO2+O2+2H2O=4HNO3,可知剩余氧气为V,反应9V其中NO2是(4/5)×9V,O2=(1/5)×9V,所以混合气体的平均相对分子质量是[(4/5)×9V×46+{10V-(4/5)×9V}×32]÷10V=42.08。若剩余气体是NO根据3NO2+H2O=2HNO3+NO相当于剩余NO23V。反应消耗气体7V。根据4NO2+O2+2H2O=4HNO3可知氧气体积为(1/5)×7V. NO2体积为{10V-(1/5)×7V }.混合气体平均相对分子质量为:[{10V-(1/5)×7V }×46+(1/5)×7V×32] ÷10V=44.04.2与O2混合气体与水反应的情况的计算的知识。
本题难度:一般
5、选择题 体积为1L的干燥容器中充入氨气,测得容器中气体对氢气的相对密度为9.7。用此气体进行喷泉实验,当喷泉停止后,进入容器中液体的体积约是(? )
A.0.2L
B.0.25L
C.0.75L
D.0.8L
参考答案:D
本题解析: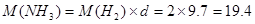 ,则根据“十字交叉”法可得它们的物质的量关系为:
,则根据“十字交叉”法可得它们的物质的量关系为:

即可知,在1L容器中,进入容器中液体的体积约是0.8L;
本题难度:一般