1、选择题 在恒容条件下化学反应: 2SO2 ( g ) + O2 ( g )  ?2SO3( g ) ; △ H =—QkJ·mol-1
?2SO3( g ) ; △ H =—QkJ·mol-1
在上述条件下分别充入的气体和反应放出的热量 ( Q )如下表所列:
容器
| SO2 (mol)
| O2(mol)
| N2(mol)
| Q(kJ·mol-1)
|
甲
| 2
| 1
| 0
| Q1
|
乙
| 1
| 0.5
| 0
| Q2
|
丙
| 1
| 0.5
| 1
| Q3
|
根据以上数据,下列叙述正确的是(?)
A.在上述条件下反应生成 lmolSO3固体放热 Q/2 kJ
B.Q= Q1 <2Q2<2Q3
C.Ql ="2" Q2= 2Q3 = Q
D.2Q2 = 2Q3 < Q1 < Q
参考答案:D
本题解析:反应前后气体化学计量数不相等,压强增大,利于正反应方向,甲加入的物料是乙的两倍,但乙中压强减小,正反应速率小于1/2甲中的正反应速率,所以2Q2<Q1,在丙中充入了惰性气体,容积不变,整体压强增大,但有效压强不变,故Q3=Q2,故选D。
点评:影响化学平衡的因素主要有温度、压强、浓度,本题较为简单
本题难度:一般
2、选择题 在一密闭容器中,反应mA(g )  ?nB(g) 达到平衡后,保持温度不变,改变容器体积(V)时,B的浓度变化如图所示,以下判断正确的是
?nB(g) 达到平衡后,保持温度不变,改变容器体积(V)时,B的浓度变化如图所示,以下判断正确的是

A.物质B的质量分数增加
B.平衡向逆反应方向移动
C.物质A的转化率减小
D.化学计量数:m>n
参考答案:A
本题解析:从图示可看出,当体积为2V时,B的浓度是原浓度的一半以上,说明减压时,平衡正向移动,B的质量分数增加,A的转化率增大,气体系数m<n,故答案为A
本题难度:简单
3、填空题
物质
| NaCl
| MgCl2
| AlCl3
| SiCl4
|
沸点/℃
| 1465
| 1412
| 181(升华)
| 57.6
|
①从表中的数据,结合学过的化学知识,你能得到的规律是?。
②以上四种物质中,属于共价化合物的是?。
③若你得到的规律具有普遍性,则以下两种物质的沸点高低是:LiCl?BCl3(填“>”、“==”、“<”)。
(2)在密闭容器中,将1.0mol CO与1.0mol H2O混合加热到800℃,发生下列反应:
CO(g)+H2O(g) CO2(g)+H2(g)
CO2(g)+H2(g)
一段时间后该反应达到平衡,测得CO的物质的量为0.5mol。
回答下列问题:
①平衡时CO的转化率为?,该反应的化学平衡常数为?。
②如果继续向该平衡体系中通入1.0mol的H2O(g),相同条件下反应达到新的平衡状态,则CO的转化率将?(填“增大”、“减小”、“不变”),预计CO的转化率为?。
③427℃时该反应的平衡常数为9.4,请结合①中的计算结果判断该反应的△H?0(填“>”、“==”、“<”)。
参考答案:(1)①第三周期元素的氯化物,自钠到硅,键型由离子化合物过渡到共价化合物,沸点显著地降低。(2分)?②SiCl4、AlCl3(2分)?③﹥(1分)
(2)①50%(1分),1(1分)②增大(1分),66.7%(或0.667)(2分)③﹤(1分)
本题解析:(1)①从表中数据可以看出它们的沸点依次降低,且前面两种物质的沸点远高于后面两种,由晶体结构的有关知识可知,它们应属于不同的晶体类型,前两个为典型的金属与典型的非金属形成的化合物,应为离子化合物,属于离子晶体,所以沸点较高;后两者沸点很低只能是属于分子晶体,是共价化合物;所以可得出的规律是:第三周期元素的氯化物,自钠到硅,键型由离子化合物过渡到共价化合物,沸点显著地降低。②由前面分析可知为SiCl4、AlCl3共价化合物;③从上面的规律可知排在周期表左边的氯化物的沸点比在右边的要高,而Li在B的左边,故LiCl >BCl3;
(2)①?CO(g)+H2O(g) CO2(g)+H2(g)
CO2(g)+H2(g)
开始:?1? 1? 0? 0
转化:? 0.5? 0.5? 0.5? 0.5
平衡:?0.5?0.5? 0.5? 0.5
平衡时CO的转化率为:50%,又因为平衡时各物质的浓度相等,故平衡常数为1。
②增大一种反应物的浓度可以提高其它反应物的转化率而自己本身的转化率要降低,故如果继续向该平衡体系中通入1.0mol的水,CO的转化率将增大。
CO(g)+H2O(g) CO2(g)+H2(g)
CO2(g)+H2(g)
开始:? 1? 2? 0? 0
转化:? n? n? n? n
平衡:? 1—n? 2—n? n? n
K=n×n/(1—n)(2—n)="1?" 所以n="2/3?" 故CO的转化率为66.7%
③由800℃变到427℃,平衡常数由1增大到9.4,故降温平衡向正反应方向移动,
所以△H<0.
本题难度:一般
4、选择题 下列叙述中,不能用平衡移动原理解释的是
A.红棕色的NO2,加压后颜色先变深后变浅
B.黄绿色的氯水光照后颜色变浅
C.由H2、Br2(g)、HBr(g)气体组成的平衡体系加压后颜色变深
D.工业合成氨反应中加压有利于提高氨气的产率
参考答案:C
本题解析:A. 2NO2(红棕色) N2O4(无色)。加压后由于单位体积内的NO2分子数增多,所以颜色加深。增大压强,根据平衡移动原理,可逆反应向气体体积减小的方向即正反应方向移动,又使NO2的浓度又有所减小。与题目要求不符。错误。B.氯气溶于水发生反应:Cl2+H2O
N2O4(无色)。加压后由于单位体积内的NO2分子数增多,所以颜色加深。增大压强,根据平衡移动原理,可逆反应向气体体积减小的方向即正反应方向移动,又使NO2的浓度又有所减小。与题目要求不符。错误。B.氯气溶于水发生反应:Cl2+H2O H++Cl-+HClO光照发生2HClO
H++Cl-+HClO光照发生2HClO 2HCl+O2↑由于减小了生成物HClO的浓度,破坏了可逆反应的平衡,减小生成物的浓度,平衡向正反应方向移动,不断消耗氯气,使黄绿色的氯水后颜色逐渐变浅。不符合题目要求。错误。C.反应H2+Br2(g)
2HCl+O2↑由于减小了生成物HClO的浓度,破坏了可逆反应的平衡,减小生成物的浓度,平衡向正反应方向移动,不断消耗氯气,使黄绿色的氯水后颜色逐渐变浅。不符合题目要求。错误。C.反应H2+Br2(g) 2HBr(g)是应该反应前后气体体积相等的反应。当给该平衡体系加压后由于各物质的浓度都增大颜色变深。但增大压强化学平衡不发生移动。符合题意。正确。D.工业合成氨反应N2+3H2
2HBr(g)是应该反应前后气体体积相等的反应。当给该平衡体系加压后由于各物质的浓度都增大颜色变深。但增大压强化学平衡不发生移动。符合题意。正确。D.工业合成氨反应N2+3H2  2NH3的正反应是个气体体积减小的反应。增大压强,化学平衡向气体体积减小的方向即正反应方向移动。产生更多的NH3。故加压可提高NH3的产率。,不符合题意。错误。
2NH3的正反应是个气体体积减小的反应。增大压强,化学平衡向气体体积减小的方向即正反应方向移动。产生更多的NH3。故加压可提高NH3的产率。,不符合题意。错误。
本题难度:一般
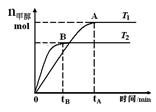
5、选择题 在恒容密闭容器中,由CO合成甲醇:CO(g) + 2H2(g) CH3OH(g),在其他条件不变的情况下,研究温度对反应的影响,实验结果如下图所示,下列说法正确的是
CH3OH(g),在其他条件不变的情况下,研究温度对反应的影响,实验结果如下图所示,下列说法正确的是
A.平衡常数K=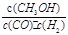
B.该反应在T1时的平衡常数比T2时的小
C.任意时刻,T2温度下的反应速率均大于T1温度下的速率
D.处于A点的反应体系从T1变到T2,达到平衡时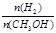 增大
增大
参考答案:C
本题解析:A、平衡常数K= ,错误;B、根据图像T2先建立平衡,所以T1<T2,温度高反应逆向移动,不利于甲醇的生成,在T1时的平衡常数比T2时的大,错误;C、速率不仅与温度有关,还与浓度、催化剂等因素有关,错误;D、吸热反应,温度升高平衡逆移,n(H2)增大,n(CH3OH)减小,正确。
,错误;B、根据图像T2先建立平衡,所以T1<T2,温度高反应逆向移动,不利于甲醇的生成,在T1时的平衡常数比T2时的大,错误;C、速率不仅与温度有关,还与浓度、催化剂等因素有关,错误;D、吸热反应,温度升高平衡逆移,n(H2)增大,n(CH3OH)减小,正确。
本题难度:一般