1、选择题 在恒容条件下化学反应: 2SO2 ( g ) + O2 ( g )  ?2SO3( g ) ; △ H =—QkJ·mol-1
?2SO3( g ) ; △ H =—QkJ·mol-1
在上述条件下分别充入的气体和反应放出的热量 ( Q )如下表所列:
容器
| SO2 (mol)
| O2(mol)
| N2(mol)
| Q(kJ·mol-1)
|
甲
| 2
| 1
| 0
| Q1
|
乙
| 1
| 0.5
| 0
| Q2
|
丙
| 1
| 0.5
| 1
| Q3
|
根据以上数据,下列叙述正确的是(?)
A.在上述条件下反应生成 lmolSO3固体放热 Q/2 kJ
B.Q= Q1 <2Q2<2Q3
C.Ql ="2" Q2= 2Q3 = Q
D.2Q2 = 2Q3 < Q1 < Q
2、选择题 在一密闭容器中,反应mA(g )  ?nB(g) 达到平衡后,保持温度不变,改变容器体积(V)时,B的浓度变化如图所示,以下判断正确的是
?nB(g) 达到平衡后,保持温度不变,改变容器体积(V)时,B的浓度变化如图所示,以下判断正确的是

A.物质B的质量分数增加
B.平衡向逆反应方向移动
C.物质A的转化率减小
D.化学计量数:m>n
3、填空题
物质
| NaCl
| MgCl2
| AlCl3
| SiCl4
|
沸点/℃
| 1465
| 1412
| 181(升华)
| 57.6
|
①从表中的数据,结合学过的化学知识,你能得到的规律是?。
②以上四种物质中,属于共价化合物的是?。
③若你得到的规律具有普遍性,则以下两种物质的沸点高低是:LiCl?BCl3(填“>”、“==”、“<”)。
(2)在密闭容器中,将1.0mol CO与1.0mol H2O混合加热到800℃,发生下列反应:
CO(g)+H2O(g) CO2(g)+H2(g)
CO2(g)+H2(g)
一段时间后该反应达到平衡,测得CO的物质的量为0.5mol。
回答下列问题:
①平衡时CO的转化率为?,该反应的化学平衡常数为?。
②如果继续向该平衡体系中通入1.0mol的H2O(g),相同条件下反应达到新的平衡状态,则CO的转化率将?(填“增大”、“减小”、“不变”),预计CO的转化率为?。
③427℃时该反应的平衡常数为9.4,请结合①中的计算结果判断该反应的△H?0(填“>”、“==”、“<”)。
4、选择题 下列叙述中,不能用平衡移动原理解释的是
A.红棕色的NO2,加压后颜色先变深后变浅
B.黄绿色的氯水光照后颜色变浅
C.由H2、Br2(g)、HBr(g)气体组成的平衡体系加压后颜色变深
D.工业合成氨反应中加压有利于提高氨气的产率
5、选择题 在恒容密闭容器中,由CO合成甲醇:CO(g) + 2H2(g) CH3OH(g),在其他条件不变的情况下,研究温度对反应的影响,实验结果如下图所示,下列说法正确的是
CH3OH(g),在其他条件不变的情况下,研究温度对反应的影响,实验结果如下图所示,下列说法正确的是
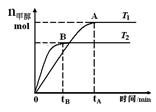
A.平衡常数K=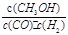
B.该反应在T1时的平衡常数比T2时的小
C.任意时刻,T2温度下的反应速率均大于T1温度下的速率
D.处于A点的反应体系从T1变到T2,达到平衡时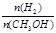 增大
增大