1、填空题 六价铬对人体有毒,含铬废水要经过化学处理后才能排放,方法是用绿矾(FeSO4·7H2O)把废水中六价铬还原成三价铬离子,再加入过量的石灰水,使铬离子生成Cr(OH)3沉淀。
(1)配平下列主要反应的化学方程式。
 H2Cr2O7+
H2Cr2O7+ FeSO4+
FeSO4+ H2SO4——
H2SO4—— Fe2(SO4)3+
Fe2(SO4)3+ Cr2(SO4)3+
Cr2(SO4)3+ H2O
H2O
(2)处理后的沉淀中有Cr(OH)3外,还有__________________ (用化学式表示)。
(3)现在处理1×103 L含铬(+6)78 mg·L-1的废水,需要绿矾_________ g。
参考答案:(1)1? 6? 6? 3? 1? 7? (2)Fe(OH)3? (3)1 251
本题解析:本题考查了氧化还原反应方程式的配平和计算。铬元素的化合价由+6降到+3,铁元素的化合价由+2升高到+3,应用得失电子守恒时要特别注意每个H2Cr2O7含有两个铬原子,再应用观察法配平整个化学方程式。
由H2Cr2O7+6FeSO4+6H2SO4====3Fe2(SO4)3+Cr2(SO4)3+7H2O可知:
2Cr—H2Cr2O7—6FeSO4·7H2O
m(FeSO4·7H2O)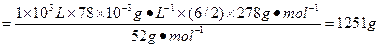
本题难度:一般
2、简答题 将?NO3-+Zn+OH-+H2O→NH3+Zn(OH)42-?配平后,离子方程式中H2O的系数是( )
A.2
B.4
C.6
D.8
参考答案:在NO3-+Zn+OH-+H2O→NH3+Zn(OH)42-?中,
Zn元素的化合价由0升高到+2价,
N元素的化合价由+5降低到-3价,
由电子守恒可知,Zn的化学计量数为4,NO3-的化学计量数为1,则
NO3-+4Zn+OH-+H2O→NH3+4Zn(OH)42-,
由电荷守恒,则
NO3-+4Zn+7OH-+H2O→NH3+4Zn(OH)42-,
再由H原子守恒可知,
NO3-+4Zn+7OH-+6H2O═NH3+4Zn(OH)42-,
即离子方程式中H2O的系数为6,
故选C.
本题解析:
本题难度:一般
3、选择题 一定量的CuS和Cu2S的混合物投入足量的HNO3中,收集到气体V L(标准状况),向反应后的溶液中(存在Cu2+和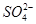 )加入足量NaOH,产生蓝色沉淀,过滤,洗涤,灼烧,得到CuO 12.0 g,若上述气体为NO和NO2的混合物,且体积比为1∶1,则V可能为
)加入足量NaOH,产生蓝色沉淀,过滤,洗涤,灼烧,得到CuO 12.0 g,若上述气体为NO和NO2的混合物,且体积比为1∶1,则V可能为
A.9.0 L
B.13.5 L
C.15.7 L
D.16.8 L
参考答案:A
本题解析:若混合物全是CuS,其物质的量为12/80=0.15 mol,电子转移数0.15 mol×(6+2)=1.2 mol。两者体积相等,设NO x mol,NO2 x mol,3x+x=1.2,计算的x=0.3。气体体积V=0.6 mol×22.4 L·mol-1=13.44 L;若混合物全是Cu2S,其物质的量为0.075 mol,转移电子数0.075 mol×10=0.75 mol,设NO x mol,NO2 x mol,3x+x=0.75,计算得x=0.187 5,气体体积V=0.375 mol×22.4 L·mol-1=8.4 L,因此8.4 L<V<13.44 L。
本题难度:一般
4、填空题 已知:2Fe + 3Br2 = 2FeBr3,Fe2+的还原性大于Br-现有16.8g铁和0.3molBr2反应后加入适量水后,通入amolCl2。
①.当a≤0.15时,反应离子方程式为?
②.当Fe2+与Br-同时被氧化时,a的取值范围为?
③.当a=0.3时,反应后氧化产物与还原产物的物质的量之比为??比?
参考答案:⑴2Fe2+ + Cl2 = 2Fe3+ + 2Cl- ⑵? 0.15 < a? ⑶9:4
(根据方程式6FeBr2+6Cl2=4FeCl3+2FeBr3+3Br2 得出9:4)
本题解析:略
本题难度:简单
5、填空题 将0.08mol KMnO4固体(质量为12.64g)加热一段时间后,收集到a molO2;向反应后残留的固体中加入足量的浓盐酸,又收集到b molCl2,此时Mn元素全部以Mn2+的形式存在于溶液中。
(1)请配平下列方程式:___KMnO4+___HCl →___KCl+___MnCl2+___Cl2↑+___H2O
(2)上式反应中的还原剂是_______,当还原剂失去1mol电子时,氧化产物的物质的量为_______mol。
(3)a+b的最大值为_________,a+b最小值为_________。
(4)当a+b =0.18时,残留固体的质量为_________g。
参考答案:(1)2、16、2、2、5、8
(2)HCl;0.5
(3)0.2;0.16
(4)12g
本题解析:
本题难度:一般