1、选择题 24mL 0.05 mol/L的Na2SO3溶液,恰好与20mL 0.02 mol/L的K2Cr2O7溶液完全反应,则Cr在还原产物中的化合价是?
A.+6
B.+3
C.+2
D.0
参考答案:B
本题解析:
摩尔失2 mol电子,设每molK2Cr2O7得n mol电子,则:
20×0.02×n=24×0.05×2? n=6
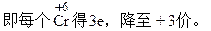
本题难度:一般
2、简答题 人类与食盐关系密切,食盐在老百姓生活和现代社会的工农业生产中均有重要作用.粗盐中含有Ca2+、Mg2+、SO42-以及泥沙等杂质,请回答粗盐提纯的有关问题:
(1)为了除去粗盐中的泥沙,可采取的提纯实验操作方法的名称是______.
(2)为了除去可溶性杂质,可以按以下实验步骤进行提纯:①加过量BaCl2溶液;②加过量NaOH溶液;③加过量Na2CO3溶液;④过滤;⑤______.请补全实验步骤,并回答步骤③的目的是______.
(3)2010年7月26日,卫生部公布了《食用盐碘含量》的征求意见稿,面向社会征求意见.对于食用盐中碘含量平均水平的规定有所降低.食盐中添加的是KIO3.可用下列反应来检验食盐中是否含KIO3:KIO3+KI+H2SO4-I2+K2SO4+H2O?(未配平).请配平该反应并表示出电子转移的方向和数目______;为了获取反应后溶液中的I2,可采取的实验操作方法的名称是______.
参考答案:(1)可以先将粗盐和其中的泥沙溶解于水,氯化钠是易溶于水的,而泥沙是难溶于水的,而固体和液体的分离可以采用过滤方法,故答案为:溶解、过滤;
(2)在粗盐提纯时,要在最后一步加入盐酸,除去过量的氢氧根离子和碳酸根离子,加入碳酸钠的目的是除去钙离子和多余的钡离子,故答案为:加适量盐酸;?除去Ca2+及过量Ba2+;
(3)根据电子守恒和原子守恒来配平方程式,在氧化还原反应KIO3+5KI+3H2SO4=3I2+3K2SO4+3H2O中,化合价升高值=化合价降低值=转移电子数=6,电子转移情况如下:
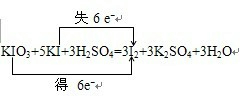
,碘单质从碘水中提取可以采用萃取分液法,利用四氯化碳来萃取,然后根据四氯化碳和碘的沸点的不同来分离,
故答案为:

;萃取、蒸馏.
本题解析:
本题难度:一般
3、填空题 废旧锂离子池的正极材料(主要含有LiCoO2及少量的Al、Fe等)可用于回收钴、锂,工艺流程如下:
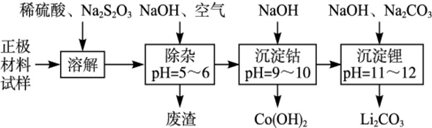
(1)在上述溶解过程中,S2O32-被氧化成SO42-,LiCoO2在溶解过程中发生反应的化学方程式为 ,还原产物是 。
(2)在上述除杂过程中,通入空气的作用是 废渣的主要成分是 。
(3)“沉淀钴”和“沉淀锂”的离子方程式分别为 。
(4)除了废渣可以回收利用外,本工艺还可回收的副产品是 。
参考答案:(1)8LiCoO2+Na2S2O3+11H2SO4=4Li2SO4+8CoSO4+Na2SO4+1lH2O CoSO4
(2)将Fe2+氧化成Fe3+;Al(OH)3 Fe(OH)3
(3)Co2++2OH-=Co(OH)2;2Li+CO32-=Li2CO3
本题解析:(1)正极材料主要含有LiCoO2及少量Al、Fe等,加入稀H2SO4、Na2S2O3,S2O32-被氧化成SO42-,具有还原性,正极材料中只有LiCoO2具有氧化性,与反应Na2S2O3反应生成CoSO4,反应化学方程式为:8LiCoO2+Na2S2O3+11H2SO4=4Li2SO4+8CoSO4+Na2SO4+11H2O,该反应中还原产物是 CoSO4,
(2)弱酸性条件下,铝离子和氢氧根离子反应生成氢氧化铝沉淀,亚铁离子和氢氧根离子反应生成氢氧化亚铁沉淀,但氢氧化亚铁不稳定易被氧气氧化生成氢氧化铁沉淀,所以废渣的成分是氢氧化铝和氢氧化铁。通入空气的作用是将亚铁离子氧化生成铁离子而除去。
(3)根据工艺流程图可知,钴离子和氢氧根离子反应生成氢氧化钴沉淀,离子方程式为:Co2++2OH-=Co(OH)2↓,碳酸根离子和锂离子反应生成碳酸锂沉淀,2Li++CO32-=Li2CO3↓
(4)稀硫酸和氢氧化钠、硫代硫酸钠反应都生成硫酸钠,且硫酸钠是可溶性的,所以溶液中存在硫酸钠,则还可以得到副产物Na2SO4。
本题难度:困难
4、选择题 将0.2mol的Cu2S跟足量稀HNO3反应,生成Cu(NO3)2、H2SO4、NO和H2O,则参加反应的HNO3中被还原的HNO3的物质的量是
A.0.4/3 mol
B.2/3 mol
C.0.8 mol
D.2 mol
参考答案:B
本题解析:Cu2S可失去10e—,而硝酸中的N元素可得到3e—,由电子的得失守恒可知:被还原的HNO3的物质的量为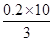 ="2/3" mol
="2/3" mol
本题难度:一般
5、填空题 利用I2O5可消除CO污染或定量测定CO,反应为:5CO(g)+I2O5(s) 5CO2(g)+I2(s);ΔH 1
5CO2(g)+I2(s);ΔH 1
(1)已知:2CO(g)+O2(g) 2CO2(g);ΔH 2
2CO2(g);ΔH 2
2I2(s)+5O2(g) 2I2O5(s);ΔH 3
2I2O5(s);ΔH 3
则ΔH 1=?(用含ΔH 2和ΔH 3的代数式表示)。
(2)不同温度下,向装有足量I2O5固体的2 L恒容密闭容器中通入2molCO,测得CO2的体积分数φ(CO2)随时间t变化曲线如图。请回答:

①从反应开始至a点时的反应速率为v(CO)=?,b点时化学平衡常数Kb=?。
②d点时,温度不变,若将容器体积压缩至原来的一半,请在图中补充画出CO2体积分数的变化曲线。
③下列说法正确的是?。(填字母序号)
A.容器内气体密度不变,表明反应达到平衡状态
B.两种温度下,c点时体系中混合气体的平均相对分子质量相等
C.增加I2O5的投料量有利于提高CO的转化率
D.b点和d点的化学平衡常数:Kb<Kd