1、实验题 (8分)硝酸具有强的氧化性,并且浓度不同,氧化能力也不同。
(1)质量分数为63%,密度为 1.5 g·cm-3的浓硝酸,其物质的量浓度为?。
(2)某学习小组为比较浓、稀硝酸分别与铜反应的不同,需配制100mL 3 mol·L-1稀硝酸,他们需要量取上述浓硝酸 ? mL;如下图所示仪器,在配制过程中不需用到的是?( 填序号)。
填序号)。
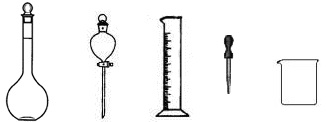
? A B C? D? E
除图中已有的仪器外,配制上述溶液还需用到的玻璃仪器是?;
参考答案:(8分)
(1)15 mol·L-1?(2分)
(2)20.0mL;B;玻璃棒?(各2分,共6分)
本题解析:略
本题难度:简单
2、选择题 用如图所示实验装置(夹持仪器已略去)探究铜丝与过量浓硫酸的反应。下列实验方法不合理的是
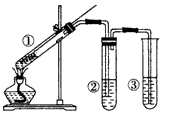
[? ]
A.上下移动①中铜丝可控制SO2的量
B.②中选用品红溶液验证SO2的生成
C.③中选用NaOH溶液吸收多余的SO2
D.为确认CuSO4生成,向①中加水,观察颜色
参考答案:D
本题解析:
本题难度:一般
3、实验题 某校实验小组进行实验研究(实验装置示意图如下)。
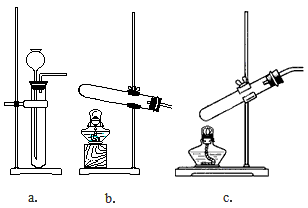
(1)制取氧气可选用的发生装置是_________(填字母序号)。该小组用制取的氧气进行硫在氧气中燃烧的性质实验时,在集气瓶底加入了少量氢氧化钠溶液。盛放该溶液的目的是__________________。
(2)①该小组用装置b制得NH3。其反应的化学方程式为__________________。
②该小组用装置b进行铁和水蒸气的反应,其化学方程式为__________________。
(3)该小组用装置c可进行的实验有__________________(写出一个即可)。
参考答案:(1)a、b;充分吸收生成的二氧化硫,减少污染空气(2)①2NH4Cl + Ca(OH)2 CaCl2 + 2H2O + 2NH3↑;②3Fe +4H2O
CaCl2 + 2H2O + 2NH3↑;②3Fe +4H2O Fe3O4 + 4H2(3)浓硫酸和铜反应
Fe3O4 + 4H2(3)浓硫酸和铜反应
本题解析:
本题难度:一般
4、实验题 在研究硝酸的性质时,某班学生做了如下三个实验:
实验一:试管中加入铜片和浓硝酸,片刻后,立即塞上带有玻璃导管的橡皮塞,导管伸入装有氢氧化钠溶液的烧杯中。
实验二:试管中加入铜片和稀硝酸(可适当加热),片刻后,塞上带有玻璃导管的橡皮塞,导管伸入装有氢氧化钠溶液的烧杯中。
实验三:试管中加入红热的木炭和浓硝酸,片刻后,立即塞上带有玻璃导管的橡皮塞,导管伸入装有氢氧化钠溶液的烧杯中。
问:
(1)实验一中硝酸在反应中表现出__________ 性。
(2)实验二现象_______________。
(3)实验三中发生反应的化学方程式______________。
(4)将实验一产生的NO2气体和氧气的混合气体共10 mL充满量筒,倒立在盛有水的水槽中,充分反应后,最后剩余1 mL气体,问原混合气体中NO2和O2的体积分别为_______ mL、______ mL或_____ mL、______mL
参考答案:(1)氧化性,酸性?
(2)溶液变蓝色,产生无色气泡,试管口气体变红棕色,固体溶解
(3)C + 4HNO3 → CO2 + 4NO2↑ + 2H2O
(4)7.2mL; 2.8 mL ;8.6 mL ;1.4 mL
本题解析:
本题难度:一般
5、填空题 (10分)为测定氯化钾和硫酸钾混合物中氯化钾的含量,某同学设计了如下实验:称量样品,溶解,添加适量A溶液,过滤,得沉淀和滤液B,将沉淀洗涤,烘干,得物质C。
回答下列问题:
(1)溶液A溶质的化学式_____,物质C的化学式____。
(2)用托盘天平称量样品,当天平平衡时,发现左盘错放砝码质量为26g,游码为0.4g,则右盘样品实际质量是____。
(3)若过滤使用的仪器和用品已有:滤纸、铁架台、铁圈、烧杯、漏斗,还需要补充的仪器或用品是______。
(4)若C的质量为 23.3g,则原混合物中氯化钾的质量分数为______。
23.3g,则原混合物中氯化钾的质量分数为______。
参考答案:BaCl2;BaSO4;25.6g;玻璃棒;32%
本题解析:略
本题难度:一般