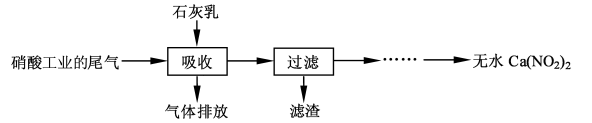
1、实验题 (12 分)利用石灰乳和硝酸工业的尾气(含NO、NO2)反应,既能净化尾气,又能获得应用广泛的Ca(NO2)2,其部分工艺流程如下:
(1)一定条件下,NO 与NO2存在下列反应:NO(g)+NO2(g) N2O3(g),其平衡常数表达式为K = ??。
N2O3(g),其平衡常数表达式为K = ??。
(2)上述工艺中采用气-液逆流接触吸收(尾气从吸收塔底进入,石灰乳从吸收塔顶喷淋), 其目的是?;滤渣可循环使用,滤渣的主要成分是?(填化学式)。
(3)该工艺需控制NO 和NO2物质的量之比接近1 颐1。若n(NO):n(NO2)>1 颐1,则会导致?;若n(NO):n(NO2)<1 颐1,则会导致?。
(4)生产中溶液需保持弱碱性,在酸性溶液中Ca(NO2)2会发生分解,产物之一是NO,其反应的离子方程式为?。
参考答案:(1) c(N2O3)/c(NO)·c(NO2)? (2)使尾气中的NO、NO2被充分吸收? Ca(OH)2
(3)排放气体中NO 含量升高?产品Ca(NO2)2中Ca(NO3)2含量升高
(4)3NO2 -+2H+ =NO3- +2NO↑+H2O
本题解析:(1)考查平衡常数概念,将反应物生成物浓度代入平衡常数的表达式中。
(2)反应中逆流操作能使反应物之间充分接触,反充分应能提高原料的利用率;反应消耗N2O3,促进气体转化的平衡正向反应,最后完全吸收,过滤得到的残渣是过量的氢氧化钙。
(3)若NO量较多,NO不能被碱吸收,排放的气体中会含有较多的NO,若NO2的量较多,NO2会与碱反应生成亚硝酸钙和硝酸钙的混合物,即亚硝酸钙中含硝酸钙。
(4)根据氧化还原反应规则,反应生成NO时元素化合价降低,则必有元素化合价升高,经分析只能是N元素化合价升高,即生成硝酸钙。
【考点定位】工业制取Ca(NO2)2的流程分析
本题难度:一般
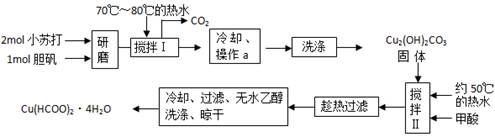
2、实验题 (14分)、实验室制备甲酸铜晶体[Cu(HCOO)2·4H2O]的流程如下:
回答下列问题:
⑴小苏打和胆矾一起研磨的目的是?。
⑵生成碱式碳酸铜[Cu2(OH)2CO3]的离子方程式为?__?。
⑶操作a的名称是?__?,该操作使用的玻璃仪器有?__?。
⑷证明碱式碳酸铜沉淀已经洗涤充分的实验操作方法是?__?;
⑸“趁热过滤”的原因是?__?;
⑹用无水乙醇洗涤晶体的目的是?__?。
参考答案:⑴加快反应速率
⑵2Cu2+ + 4HCO3— = Cu2 (OH)2CO3 ↓ +3CO2? + H2O
⑶过滤?玻璃棒、漏斗、烧杯
⑷取最后滤出的洗涤液少许,加入盐酸酸化的BaCl2溶液,无明显现象?
⑸防止甲酸铜结晶而损失
⑹除去甲酸并减少甲酸铜晶体损失
本题解析:⑴两物质均易结块,将两固体一起研磨可增大反应物的接触面积,加快反应速率
(2)由流程图可看出,两反应物在热水中生成了Cu2(OH)2CO3,同时有CO2气体生成:2Cu2+ + 4HCO3— = Cu2 (OH)2CO3 ↓ +3CO2? + H2O
(3)固体与液体分离时可采用过滤的方法,所用的玻璃仪器包括:玻璃棒、漏斗、烧杯
(4)在生成Cu2 (OH)2CO3 的溶液中存在SO42—及Na+,故可能检验SO42—是否存在来判定沉淀是否洗涤干净:取滤液少许,加入盐酸酸化的BaCl2溶液,无明显现象,即可证明
(5)蒸发浓缩后甲酸铜的浓度比较高,如果冷却至常温会以晶体的形式析出,故要“趁热”过滤;
(6)甲酸可溶于乙醇中被除去,同时甲酸铜不溶于乙醇,可减小产品损失,故选用无水乙醇洗涤晶体
本题难度:一般
3、选择题 下列实验操作中一定会造成实验值偏小的是(? )
A.将pH试纸用蒸馏水湿润后测某溶液的pH
B.配制500mL 0.10mol/L NaCl溶液,定容时俯视
C.以标准盐酸溶液滴定未知浓度的NaOH溶液时,酸式滴定管未用标准溶液润洗
D.用标准NaOH溶液滴定未知浓度的盐酸溶液,开始时滴定管尖嘴处没有气泡,结束时有气泡
参考答案:D
本题解析:A项用pH试纸测溶液的pH时不能润湿,否则因润润湿导致溶液被稀释使所测pH不准确;B项定容时俯视液面低于刻度线,浓度偏高;C酸式滴定管未用标准溶液润洗,导致标准液浓度偏低,需要的体积偏大,待测液浓度偏高;D项测得标准液体积偏小,待测液浓度偏小。
点评:定量实验中误差分析要依据原理来分析。
本题难度:简单
4、选择题 如图装置可用于收集气体并验证其某些化学性质(不考虑烧杯中液体倒吸现象),你认为正确的是( )
| 选项 | 气体 | 试剂 | 现象 | 结论
A
X
澄清石灰水
溶液变浑浊
X是CO2
B
Cl2
紫色石蕊试液
溶液先变红后褪色
Cl2有酸性和漂白性
C
NO2
KI淀粉溶液
溶液变蓝
NO2水溶液有氧化性
D
NH3
酚酞试液
溶液变红色
NH3的水溶液显碱性
|
A.A
B.B
C.C
D.D
