?
参考答案:(13分)(1)生石灰(或氢氧化钠固体)(1分)? d(1分)
打开分液漏斗上口的活塞(或将活塞上的凹槽与瓶口上的小孔对齐),旋开分液漏斗的旋塞,缓慢滴加。(2分)
(2)ACDF (2分,答对2~3个得1分,答对4个得2分,有错误答案即得0分)
(3)将广口瓶Ⅱ中装满液体,连接cf,NH3从d管通入(2分)? c(1分)使量筒与广口瓶液面相平(1分)
(4) (3分)
装置序号
仪器中所加物质名称
目的或现象
Ⅰ
稀盐酸、碳酸钠固体
固体溶解有气泡产生
Ⅱ
饱和NaCl溶液
吸收CO2中的HCl
Ⅲ
硅酸钠溶液
有白色胶状沉淀出现
本题解析:略
本题难度:一般
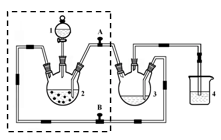
3、实验题 (13分)醋酸亚铬水合物([Cr(CH3COO)2)]2·2H2O,深红色晶体)是一种氧气吸收剂,通常以二聚体分子存在,不溶于冷水和醚,微溶于醇,易溶于盐酸。实验室制备醋酸亚铬水合物的装置如图所示,涉及的化学方程式如下:
Zn(s) + 2HCl(aq) = ZnCl2(aq) + H2(g)
2CrCl3(aq) + Zn(s)= 2CrCl2 (aq) + ZnCl2(aq)
2Cr2+(aq) + 4CH3COO-(aq) + 2H2O(l) = [Cr(CH3COO)2]2·2H2O (s)
请回答下列问题:
(1)检查虚框内装置气密性的方法是?。
(2)醋酸钠溶液应放在装置?中(填写装置编号,下同);盐酸应放在装置?中;
装置4的作用是?。
(3)本实验中所有配制溶液的水需煮沸,其原因是?。
(4)将生成的CrCl2溶液与CH3COONa溶液混合时的操作是?阀门A、?阀门B (填“打开”或“关闭”)。
(5)本实验中锌粒须过量,其原因是?。?
(6)为洗涤[Cr(CH3COO)2)]2·2H2O产品,下列方法中最适合的是?。?
A.先用盐酸洗,后用冷水洗? B.先用冷水洗,后用乙醇洗
C.先用冷水洗,后用乙醚洗? D.先用乙醇洗涤,后用乙醚洗
参考答案:(1)将装置连接好,关闭A、B阀门,往装置1中加水,打开活塞后,水开始下滴,一段时间后,如果水不再下滴,表明装置气密性良好。反之,则气密性不好(2分,其它合理答案也给分);
(2)装置3,装置1(各1分);可以防止空气进入装置3(1分,其它合理答案也给分)。
(3)去除水中的溶解氧,防止Cr2+被氧化 (2分)
(4)打开;关闭?(各1分)
(5)产生足够的H2;与CrCl3充分反应得到CrCl2?(2分)
(6)C?(2分)
本题解析:(1)可利用装置内外压强差来验证装置的气密性:将装置连接好,关闭A、B阀门,往装置1中加水,打开活塞后,水开始下滴,一段时间后,如果水不再下滴,表明装置气密性良好。反之,则气密性不好;(2)整套装置的工作原理是:先在装置2中制备出二价的铬离子,在制备过程中,因为二价铬离子容易被空气中的氧气氧化成三价。因此在装置2中,我们要放入足够多的锌粒,一是还原三价铬,二是用来产生氢气排除装置内的空气。反应开始前,应该先打开B让氢气充满整个装置,然后 再关闭B,打开A,让装置2中的二价铬离子进入装置3,跟醋酸钠反应生成醋酸亚铬水合物。因此,醋酸钠溶液应放在装置3中,盐酸应放在装置1中;装置4的作用是:可以防止空气进入装置3。(3)本实验中所有配制溶液的水需煮沸,其原因是:去除水中的溶解氧,防止Cr2+被氧化(4)将生成的CrCl2溶液与CH3COONa溶液混合时的操作是打开阀门A、关闭阀门B;这样装置2中的溶液就可以在氢气的压力下,将液体压往装置3中进行反应。(5)本实验中锌粒须过量,其原因是:①产生足够的H2;②与CrCl3充分反应得到CrCl2?。(6)洗涤[Cr(CH3COO)2)]2·2H2O产品,主要是洗去附着在表面的没有反应掉的二价铬离子、氯离子、醋酸根离子、钠离子等,不能用乙醇和盐酸,因为醋酸亚铬水合物,是微溶于醇,易溶于盐酸。因此先用水洗去杂质离子,再用乙醚来洗去多余的水。多余的乙醚可以挥发掉,选C 。
本题难度:一般
4、选择题 实验室制取下列气体时,下列尾气吸收方法中不正确的是
A.Cl2的尾气,可用NaOH溶液吸收
B.NH3的尾气,可用H2SO4溶液吸收
C.SO2的尾气,可用酸性KMnO4溶液吸收
D.NO2的尾气,可用H2O来吸收
参考答案:D
本题解析:
答案:D
A ?Cl2+2NaOH=NaCl+NaClO+H2O
B? 2NH3+H2SO4=(NH4)2SO4
C? 5SO2+2MnO4―+2H2O=5SO42―+2Mn2++4H+
D?应用NaOH或Na2CO3等来吸收
本题难度:一般
5、实验题 (12分)乙醇的沸点是78℃,能与水以任意比例混溶。乙醚的沸点为34.6℃,难溶于水,在饱和Na2CO3溶液中几乎不溶,乙醚极易燃烧。实验室制乙醚的反应原理是

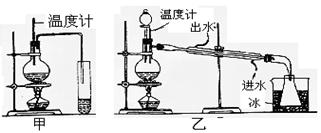
(1)图甲和乙是两套实验室制乙醚的装置,选装置?最合适,理由是?__?。
(2)反应液中应加入沸石,其作用是?。
(3)反应中温度计水银球的位置是? __________________??。
(4)用装置乙制得的乙醚中可能含有大量的杂质,这杂质是??,除去这种杂质的简易方法是??。
(5)如果温度太高将会有乙烯生成,该反应的化学方程式是?
??,反应类型是?。
参考答案:(1)乙(1分);冷却效果好,乙醚远离火源(2分)。(2)防止暴沸。(1分)(3)插入反应物液面以下,但不能触及瓶底。(2分)(4)乙醇(1分);将其与饱和Na2CO3溶液混合,后静置分液。(2分)
(5)? CH3CH2OH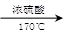 CH2=CH2↑+H2O(2分)?消去(1分); CH2=CH2↑+H2O(2分)?消去(1分);
本题解析:(1)乙装置有冷凝管,冷却效果好。因为乙醚极易挥发、易燃烧,而乙装置中收集乙醚的锥形瓶离酒精灯较远,比较安全。
(2)反应需要加热,为防止液体受热时剧烈跳动,需要用碎瓷片以防暴沸。
(3)生成乙醚的温度是140℃,温度如果超过140℃,就有可能生成乙烯,所以必须可知溶液的温度。因此温度计的水银球要插入反应物液面以下,但不能触及瓶底。
(4)由于乙醇也易挥发,所以生成的乙醚中会混入乙醇。乙醇和水互溶,乙醚在饱和Na2CO3溶液中几乎不溶,所以可通过饱和碳酸钠溶液来除去乙醇。
(5)在170℃时乙醇会发生消去反应生成乙烯,方程式为
CH3CH2OH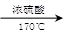 CH2=CH2↑+H2O。 CH2=CH2↑+H2O。
本题难度:一般
|