将FeCl3溶液加入Mg(OH)2悬浊液中,振荡,可观察到沉淀由白色变为红褐色
参考答案:B
本题解析:A、溴乙烷在氢氧化钠的溶液中加热发生水解生成乙醇、溴化钠。在酸性条件下溴化钠与硝酸银溶液反应产生淡黄色沉淀溴化银,能达到实验目的,A正确;B、在酸性条件下,NO3-具有氧化性,能把Fe2+氧化生成铁离子,铁离子与KSCN溶液发生显色反应,溶液显红色,不能达到实验目的,B不正确;C、下层液体呈紫色,说明反应中有碘生成,即溴与碘化钾发生了置换反应生成了碘和溴化钾,这说明溴的氧化性强于碘的氧化性,C正确;D、将FeCl3溶液加入Mg(OH)2悬浊液中,振荡,可观察到沉淀由白色变为红褐色,说明反应中有氢氧化铁生成。根据沉淀容易向更难溶的方向转化可知Fe(OH)3的溶解度小于Mg(OH)2的溶解度,D正确,答案选B。
本题难度:一般
3、实验题 某研究性学习小组设计了一组实验来探究元素周期律。甲同学根据元素非金属性与对应最高价含氧酸之间的关系,设计了如图装置来一次性完成N、C、Si的非金属性强弱比较的实验研究;乙同学根据置换反应的规律,利用下图装置完成了O元素的非金属性比S强的实验研究。回答下列问题:

(1)图中D装置在实验中的作用是________________。
(2)从以下所给物质中选出甲同学设计的实验所用到物质:图中试剂A为_________;试剂C为_________(填序号)。
①稀HNO3溶液?②稀盐酸?③碳酸钙?④Na2SiO3溶液?⑤SiO2?
(3)写出烧瓶中发生反应的离子方程式____________________。写出试管C中发生反应的离子方程式___________________________。由此判断,元素N、C、Si?非金属性由弱到强的顺序为___________。
(4)乙同学设计的实验所用到试剂A为________;试剂B为________;试剂C为________。 C处的现象为浅黄色沉淀产生;写出C中发生反应的化学方程式为______________。
参考答案:(1)防倒吸
(2)①;④
(3)2H++CaCO3=Ca2++H2O+CO2↑;H2O+CO2+?SiO32-=?H2SiO3↓+?CO32-;Si?C?N
(4)双氧水;二氧化锰;氢硫酸或硫化钠溶液;2H2S+O2=2S↓+2H2O
本题解析:
本题难度:一般
4、简答题 硫代硫酸钠(Na2S2O3)俗称保险粉,可用于照相业作定影剂,也可用于纸浆漂白作脱氯剂等.实验室可通过如下反应制取:2Na2S+Na2CO3+4SO2═3Na2S2O3+CO2.
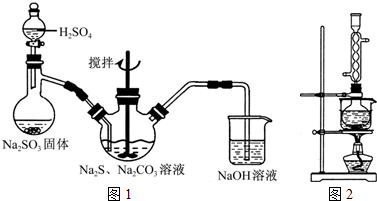
(1)用图1所示装置制取Na2S2O3,其中NaOH溶液的作用是______.如将分液漏斗中的H2SO4改成浓盐酸,则三颈烧瓶内除Na2S2O3生成外,还有______(填化学式)杂质生成.
(2)为测定所得保险粉样品中Na2S2O3?5H2O的质量分数,可用标准碘溶液进行滴定,反应方程式为2Na2S2O3+I2═2NaI+Na2S4O6.
①利用KIO3、KI和HCl可配制标准碘溶液.写出配制时所发生反应的离子方程式:______.
②准确称取一定质量的Na2S2O3?5H2O样品于锥形瓶中,加水溶解,并滴加______作指示剂,用所配制的标准碘溶液滴定.滴定时所用的玻璃仪器除锥形瓶外,还有______.
③若滴定时振荡不充分,刚看到溶液局部变色就停止滴定,则会使样品中Na2S2O3?5H2O的质量分数的测量结果______(填“偏高”“偏低”或“不变”).
(3)本实验对Na2S的纯度要求较高,利用图2所示的装置可将工业级的Na2S提纯.已知Na2S常温下微溶于酒精,加热时溶解度迅速增大,杂质不溶于酒精.提纯步骤依次为:
①将已称量好的工业Na2S放入圆底烧瓶中,并加入一定质量的酒精和少量水;
②按图2所示装配所需仪器,向冷凝管中通入冷却水,水浴加热;
③待______时,停止加热,将烧瓶取下;
④______;
⑤______;
⑥将所得固体洗涤、干燥,得到Na2S?9H2O晶体.
参考答案:(1)装置中氢氧化钠是吸收尾气的主要作用,因为原料气二氧化硫是污染性气体不能排放到空气中,以防止污染空气;换做 盐酸进行反应产物中 除了硫代硫酸盐外还有氯化钠,
故答案为:吸收二氧化硫等尾气,防止污染空气;NaCl;
(2))①KIO3、KI和HCl可配制标准碘溶液,利用KIO3、KI在酸溶液中发生的氧化还原反应生成单质碘,反应的离子方程式为:IO3-+5I-+6H+=3I2+3H2O,
故答案为:IO3-+5I-+6H+=3I2+3H2O;
②用配制的碘溶液滴定硫代硫酸钠,利用碘单质遇碘单质变蓝指示反应终点;碘溶液具有氧化性,应选用酸式滴定管,
故答案为:淀粉溶液;酸式滴定管;
③滴定时振荡不充分,刚看到溶液局部变色就停止滴定,消耗标准溶液体积减小,则会使样品中Na2S2O3?5H2O的质量分数的测量偏低;
故答案为:偏低;
(3)由提纯硫化钠的实验步骤和操作过程可知,
③依据Na2S常温下微溶于酒精,加热时溶解度迅速增大,杂质不溶于酒精,根据提纯硫化钠晶体的实验步骤和方法可知,但烧瓶中固体不再减少,说明硫化钠全部溶解于酒精中,不溶的杂质沉淀过滤除去,故答案为:烧瓶中固体不再减少;
④温度增大硫化钠在酒精中溶解度增大,热溶液过滤得到滤液中主要是硫化钠的酒精溶液,故答案为:趁热过滤;
⑤热的滤液通过冷却、结晶、过滤得到晶体,故答案为:将所得滤液冷却结晶,过滤得到硫化钠结晶水合物.
本题解析:
本题难度:简单
5、简答题 孔雀石主要含Cu2(OH)2CO3,还含少量Fe、Si的化合物.实验室以孔雀石为原料制备CuSO4?5H2O及CaCO3,步骤如下:
请回答下列问题:
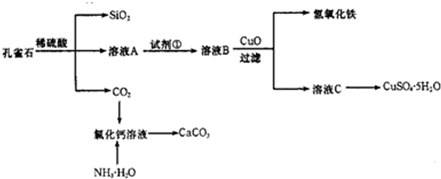
(1)溶液A的金属离子有Cu2+、Fe2+、Fe3+.从下列所给试剂中选择:实验步骤中试剂①为______(填代号),检验溶液A中Fe3+的最佳试剂为______(填代号).
a.KMnO4 b.(NH4)2S c.H2O2 d.KSCN
(2)由溶液C获得CuSO4?5H2O,需要经过加热蒸发、______、过滤等操作.过滤时为了防止滤液飞溅,应______.
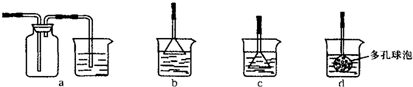
(3)制备CaCO3时,若实验过程中有氨气逸出,应选用下列______装置吸收(填代号).
(4)欲测定溶液A中Fe2+的浓度,需要用容量瓶配制KMnO4标准溶液进行氧化还原滴定,配制时等液面接近容量瓶刻度线时,应该继续进行的操作是______.滴定时需要用用KMnO4标准溶液润洗滴定管,润洗后的废液应从酸式滴定管的______排出.
参考答案:(1)由溶液B加入CuO可生成氢氧化铁沉淀可知,B应为含Fe3+的溶液,则试剂①应将Fe2+氧化为Fe3+,为不引入新的杂质,可用H2O2为氧化剂,可用KSCN检验Fe3+,
故答案为:c;d;
(2)由溶液制取晶体,需经过加热浓缩,冷却结晶才可得到,过滤时为了防止滤液飞溅,应使漏斗下端玻璃管与烧杯壁紧靠,
故答案为:冷却结晶;使漏斗下端玻璃管与烧杯壁紧靠;
(3)氨气极易溶于水,且氨气有刺激性气味,防止污染大气,要有尾气处理装置,选用倒置的漏斗且紧贴水面,目的是防止倒吸,
故答案为:b;
(4)配制溶液时要进行定容,可用胶头滴管向容量瓶中滴加蒸馏水,至溶液的凹液面正好与刻度线相平,润洗滴定管时,为充分润洗,应将润洗液从下口排出,
故答案为:用胶头滴管向容量瓶中滴加蒸馏水,至溶液的凹液面正好与刻度线相平;下口.
本题解析:
本题难度:一般
|