1、填空题 在下图中,甲烧杯中盛有100 mL0.50 mol·L-1 AgNO3溶液,乙烧杯中盛有100 mL 0.25 mol·L-1 CuCl2溶液,A、B、C、D 均为质量相同的石墨电极,如果电解一段时间后,发现A极比C 极重1.9g,则
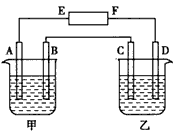
(1)电源E为_________ 极,F为___________ 极。
(2)A极的电极反应式为_________,析出物质__________ mol。
(3)B极的电极反应式为_________,析出气体__________ mL(标准状况)。
(4)C极的电极反应式为________,析出物质___________ mol。
(5)D极的电极反应式为________,析出气体___________ mL(标准状况)。
(6)甲烧杯中滴入石蕊试液,_________极附近变红,如果继续电解,在甲烧杯中最终得到________溶液。
参考答案:(1)负 ;正
(2)4Ag+ +4e- ==4Ag ;0.025
(3)4OH--4e-==2H2O+O2 ;140
(4)Cu2+ +2e-==Cu ;0.0125
(5)2Cl- -2e-==Cl2↑ ;280
(6)B ;HNO3
本题解析:
本题难度:一般
2、选择题 气态废弃物中的硫化氢可用电化学的方法转化为可利用的硫:配制一份电解质溶液,主要成分为:K4[Fe(CN)6](200 g/L)和KHCO3(60 g/L);通电电解,通入H2S气体。过程中涉及硫化氢转化为硫的总反应:2Fe(CN)63-+2CO32-+H2S=2Fe(CN)64-+2HCO3-+S,则下列说法不正确的是(?)
A.电解过程中的阳极反应为:[Fe(CN)6]2――e-=[Fe(CN)6]3-
B.电解过程中阴极附近溶液的pH降低
C.电解过程中每处理l mol硫化氢气体,理论上转移电子2 mol
D.该处理方法理论上不需要补充电解质溶液
参考答案:AB
本题解析:关键在于将总反应拆成两个半反应阳极发生失电子的反应,对应于还原剂被氧化:H2S - 2e- = 2H+ + S,生成的 H+被CO32-吸收,因此得到阳极半反应是 H2S - 2e- + 2CO32- = 2HCO3- + S阴极发生的电子的反应,对应于氧化剂被还原:[Fe(CN)6]3- + e- = [Fe(CN)6]4-A、不正确,如上所述,阳极发生还原剂被氧化的反应;B、不正确。从阴极反应式可见,没有 H+或 OH-参与,pH 应该不变;C、正确。1mol H2S 变成 1mol S,需要 2mol 电子;D、正确。从方程式可见电解质原料并没有损失,只是转化了,理论上是不需要补充的,只是需要定期再生(通些O2将[Fe(CN)6]4-氧化成[Fe(CN)6]3-即可)。 所以选AB
本题难度:一般
3、填空题 某水溶液中含有等物质的量浓度的Cu(NO3)2和MgCl2,对该溶液以惰性电极进行电解,分阶段写出电解反应的化学方程式。
第一阶段的反应:______________________________________________________________________;
第二阶段的反应:______________________________________________________________________。
参考答案:CuCl2 Cu+Cl2↑?第二阶段的反应:2H2O
Cu+Cl2↑?第二阶段的反应:2H2O 2H2↑+O2↑
2H2↑+O2↑
本题解析:惰性电极电解含有等物质的量浓度的Cu(NO3)2和MgCl2时,阴极的放电离子顺序是Cu2+、H+,阳极放电离子的顺序是Cl-、OH-,所以电解的第一阶段相当于是电解氯化铜,反应式为CuCl2 Cu+Cl2↑;电解完成后阴阳极放电离子分别是H+和OH-,所以相当于是电解水,则电解的反应式为2H2O
Cu+Cl2↑;电解完成后阴阳极放电离子分别是H+和OH-,所以相当于是电解水,则电解的反应式为2H2O 2H2↑+O2↑。
2H2↑+O2↑。
本题难度:一般
4、实验题 (14分)如图所示,以石墨为电极电解A的水溶液,并做下面一系列实验。试根据实验现象完成下列问题(电解质A的水溶液焰色反应呈紫色)。
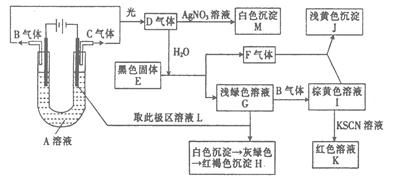
(1)A的化学式为? ?,E的名称为? ?。
(2)I和F反应的离子方程式是? ? ?。
(3)若将电解装置中的阳极换成铁棒,则在U型管底部可观察到的现象是??
? ?,阳极的电极反应式为? ?,阴极的电极反应式为? ?,电解的化学方程式为? ? ?。
参考答案:
(1)KCl;?硫化亚铁
(2)2Fe3+ + H2S==2Fe2+ + S↓+ 2H+
(3)产生了白色絮状沉淀? Fe-2e-=Fe2+? 2H++2e-=H2↑? Fe+2H2O Fe(OH)2↓+H2↑
Fe(OH)2↓+H2↑
本题解析:略
本题难度:简单
5、填空题 某种蓄电池的充放电过程可表示为:Fe(OH)2+Ni(OH)2 Fe+NiO2+2H2O,该电池充电时,阳极是________,电极反应式为__________________。
Fe+NiO2+2H2O,该电池充电时,阳极是________,电极反应式为__________________。
参考答案:Ni(OH)2;Ni(OH)2+2OH--2e-=NiO2+2H2O
本题解析:
本题难度:一般