1、推断题 (13分)硫代硫酸钠(Na2S2O3)俗称海波,它可看成是用一个S原子取代了Na2SO4中的一个O原子而形成的。某校化学研究性学习小组用类比学习思想,并通过实验探究Na2S2O3的化学性质。
【提出问题】Na2S2O3与Na2SO4结构相似,化学性质是否也相似呢?
【实验探究】取适量Na2S2O3晶体,溶于水制成Na2S2O3溶液,进行如表所示的探究,完成表中有关内容。
实验操作
| 实验现象
| 现象解释(用离子方程式表示)
|
探究①A.?
B.向pH=2的硫酸中滴加Na2S2O3溶液
| a.溶液pH=8
b.?
| i.?
ii. S2O32-+2H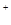 =S↓ +SO2↑ +H2O =S↓ +SO2↑ +H2O
|
探究②C.向新制氯水(pH<2)中滴加少量Na2S2O3溶液
| c.氯水颜色变浅
| iii.?
|
【实验结论】探究①?探究②?。
根据探究①和探究②的结论,Na2S2O3和Na2SO4化学性质?。
【问题讨论】
(1)甲同学向探究②反应后的溶液中滴加AgNO3溶液,出现白色沉淀,据此甲同学认为氯水可将Na2S2O3氧化。你认为此方案是否正确并说明理由:?。
(2)请你重新设计一个实验方案,证明Na2S2O3能被氯水氧化。你设计的方案是?。
参考答案:A.用玻璃棒蘸取Na2S2O3溶液点在pH试纸上,并与标准比色卡对照(1分)
i. S2O32-+H2O HS2O3-+OH-(2分)
HS2O3-+OH-(2分)
B. 有淡黄色沉淀(1分),有无色刺液性气味气体产生(1分)
iii. S2O32-+4Cl2+5H2O=2SO42-+8Cl-+10H+(2分)
探究①:Na2S2O3溶液呈碱性(1分),能与强酸反应(1分)。
探究②:Na2S2O3具有还原性(1分),不相似(1分)。
【问题与讨论】(1)不正确,因为氯水中含有Cl-(1分)。
(2)取少量探究②反应后的溶液,向其中滴入BaCl2溶液,若有白色沉淀,则说明Na2S2O3被氯水氧化。(1分)
本题解析:A.根据实验现象可知,该步操作是测定溶液pH值的,因此正确的操作应该是用玻璃棒蘸取Na2S2O3溶液点在pH试纸上,并与标准比色卡对照。
i.溶液显碱性,说明酸根水解,离子方程式为S2O32-+H2O HS2O3-+OH-。
HS2O3-+OH-。
B.根据反应的生成物有单质硫和 二氧化硫生成可知,实验现象为有淡黄色沉淀,有无色刺液性气味气体产生。
iii.氯水颜色变浅说明发生了氧化还原反应,即硫代硫酸钠被氧化,则反应的离子方程式为S2O32-+4Cl2+5H2O=2SO42-+8Cl-+10H+。
根据实验操作以及实验现象可知探究①是探究Na2S2O3溶液呈碱性,能与强酸反应。探究②是探究Na2S2O3具有还原性。由于硫酸钠不能与强酸反应,也没有还原性,所以二者的性质不相似。
【问题与讨论】(1)因为氯水中含有Cl-也能与硝酸银溶液反应产生白色沉淀,因此结论是不正确的。
(2)由于氧化产物是硫酸钠,因此可以通过验证硫酸根的生成即可,则实验操作为取少量探究②反应后的溶液,向其中滴入BaCl2溶液,若有白色沉淀,则说明Na2S2O3被氯水氧化。
本题难度:一般
2、填空题 (1)有A、B、C、D四种可溶性离子化合物,它们的阳离子是Ag+、Na+、Mg2+、Cu2+,阴离子是Cl-、OH-、NO3-、SO42-(每种离子只能用一次)现将溶液两两混合,记录现象如下:
A+B→白色沉淀B+D→白色沉淀C+D→蓝色沉淀
写出上述反应对应的离子方程式:
A+B→白色沉淀:______;
B+D→白色沉淀:______;
C+D→蓝色沉淀:______.
(2)向NaHSO4溶液中逐滴加入Ba(OH)2溶液至溶液呈中性,写出发生反应的离子方程式:______.
参考答案:(1)用表格法进行分析,将溶液两两混合的现象结果记入右表,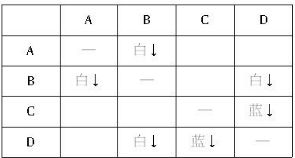
发现B与其他物质反应产生两种白色沉淀(肯定是不同的物质),而题设各离子中能组合为白色沉淀的物质有AgCl、Mg(OH)2;又D与其他物质反应产生一种白色沉淀、一种蓝色沉淀,题设各离子中能组合为蓝色沉淀的物质只有Cu(OH)2,这样可以确定D中含OH-,从而确定D为NaOH;再由“B+D→白色沉淀”确定B为MgCl2;由A、B反应情况确定A为AgNO3;由C、D反应情况确定C为CuSO4.故四种物质分别为AgNO3、MgCl2、CuSO4、NaOH,
AgNO3、MgCl反应的离子方程式为Ag++Cl-=AgCl↓;
MgCl2、NaOH反应的离子方程式为Mg2++2OH-=Mg(OH)2↓;
CuSO4、NaOH反应的离子方程式为Cu2++2OH-=Cu(OH)2↓,
故答案为:Ag++Cl-=AgCl↓;Mg2++2OH-=Mg(OH)2↓;Cu2++2OH-=Cu(OH)2↓;
(2)向NaHSO4 溶液中逐滴加入Ba(OH)2 溶液至溶液呈中性,SO42-过量,H+恰好反应,反应的离子方程式为2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O,
故答案为:2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O.
本题解析:
本题难度:一般
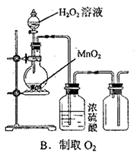
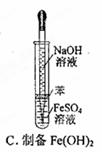
3、选择题 下图所示对试剂选用或实验操作正确的是
 ?
? ?
? ?
?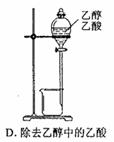
参考答案:C
本题解析:A中酸性高锰酸钾溶液应该盛放在酸式滴定管中,A不正确;氧气的密度大于空气的,应该用向下排空气法收集,B不正确;由于氢氧化亚铁极易被氧化,所以在制备氢氧化亚铁时滴管可以插入到溶液中,C正确;乙醇和乙酸是互溶的,则不能用分液法分离,而应该是蒸馏,D不正确,答案选C。
点评:化学实验常用仪器的使用方法和化学实验基本操作是进行化学实验的基础,对化学实验的考查离不开化学实验的基本操作,所以该类试题主要是以常见仪器的选用、实验基本操作为中心,通过是什么、为什么和怎样做重点考查实验基本操作的规范性和准确及灵活运用知识解决实际问题的能力。
本题难度:简单
4、填空题 (2009江苏盐城调研,17)已探明我国锰矿储量占世界第三位,但富矿仅占6.4%,每年尚需进口大量锰矿石。有人设计了把我国的菱锰矿(MnCO3)(贫矿)转化为高品位“菱锰矿砂(MnCO3)”的绿色工艺。该工艺流程如下图所示:
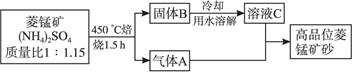
回答下列问题:
(1)气体A中含有两种气体,溶液C与气体A发生反应的化学方程式为________________。
(2)锰的化合物用途广泛,例如MnO2、KMnO4都是重要的锰化合物。MnO2可用于制备KMnO4,一般是先由MnO2在碱性条件下与O2反应制备得到K2MnO4,再由K2MnO4通过以下两种方式制备KMnO4。
方法一:电解法:2K2MnO4+2H2O 2KMnO4+2KOH+H2↑
2KMnO4+2KOH+H2↑
方法二:CO2法:3K2MnO4+2CO2====2KMnO4+MnO2↓+2K2CO3
①写出MnO2得到K2MnO4的化学方程式:_______________________________。
②以上两种制备方法,方法一相对于方法二,所具有的优点是_______________________。
③KMnO4粉末在低温下与浓硫酸作用,可生成油状液体,它在0 ℃以下是稳定的,室温下会立即发生爆炸分解,分解产物为MnO2和O2,则该物质的化学式为_________________。
参考答案:(1)MnSO4+2NH3+CO2+H2O====MnCO3↓+(NH4)2SO4
(2)①2MnO2+4KOH+O2====2K2MnO4+2H2O
②方法一可使K2MnO4完全转变成KMnO4,副产品KOH回收后可用于MnO2的碱熔氧化;得到的KMnO4较纯净
③Mn2O7
本题解析:(1)由信息可知反应前后Mn的化合价不变,所以A中气体只能是NH3、CO2,固体B为MnSO4。(2)②从元素守恒的角度分析,方法一中所有的Mn都转变为了KMnO4,得到的KMnO4较纯净;从原料利用的角度分析,副产品KOH回收后可再用。③由分解产物只有Mn、O两种元素可知该物质为+7价Mn的氧化物。
本题难度:一般
5、实验题 用如图所示装置进行实验,将A逐滴加入B中。
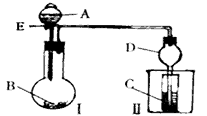
(1)若A为浓硫酸,B为第三周期金属元素的片状单质,其在常温下难与水反应;C为品红溶液,实验中观察到C中溶液褪色,则B是_______,然后往烧杯中加入沸水,又可观察到的现象是________。
(2)若B为Na2CO3,C为NaAlO2溶液,实验中观察到小试管内溶液变浑浊,则酸A的酸性比_______强,写出试管C中反应的离子方程式__________。
(3)若B是生石灰,实验中观察到C中溶液由无色变为红色,若在C中加入醋酸铵固体红色变浅,则A是__________,解释C中加入醋酸铵固体红色变浅的原因:__________(用方程式及必要的文字说明) 。
参考答案:(1)镁;C中的溶液又变为红色。
(2)碳酸;AlO2-+2H2O+CO2=Al(OH)3↓+HCO3- 或2AlO2-+3H2O+CO2=2Al(OH)3↓+CO32-
(3)浓氨水 ;NH3·H2O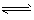 NH4+ + OH- ,加入固体醋酸铵后,使溶液中c(NH4+)增大,氨水的电离平衡向左移动,c(OH-)变小,溶液的颜色变浅。
NH4+ + OH- ,加入固体醋酸铵后,使溶液中c(NH4+)增大,氨水的电离平衡向左移动,c(OH-)变小,溶液的颜色变浅。
本题解析:
本题难度:一般