1、选择题 已知下面三个数据:7.2×10-4、4.6×10-4、4.9 ×10-10分别是下列有关的三种酸的电离常数,若已知下列反应可以发生:
NaCN+HNO2===HCN+NaNO2
NaCN+HF===HCN+NaF
NaNO2+HF===HNO2+NaF
由此可判断下列叙述不正确的是
[? ]
A.K(HF)=7.2 ×10-4
B.K(HNO2)=4.9 ×10-10
C.根据其中两个反应即可得出结论
D.K(HCN)<K(HNO2)<K(HF)
2、填空题 Ⅰ、A物质的化学式为M(OH)2,将其溶于水制成稀溶液,该溶液呈中性,在溶液中存在:
M2++2OH-?
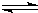
?M(OH)2?
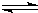
?2H++MO22-
回答以下题目一律用“增大”“减小”“不变”填空
(1)在其他条件不变的情况下,25C°?时,在蒸馏水中加入A物质后,与加入前比较,
①由水电离出的C(OH-)______,C(H+)______,水的电离度______,Kw______
(2)25C°?时,向A的稀溶液中加入少量的烧碱固体.则水的电离度______,溶液的pH______
Ⅱ、.室温下,甲、乙两瓶氨水的浓度分别为1mol/L和0.1mol/L,则甲、乙两瓶氨水中C(OH-)之比为______?10?(填大于、等于或小于)
3、选择题 用蒸馏水稀释0.1 mol/L醋酸时,始终保持增大趋势的是? ( )
A.溶液中的c(CH3COO-)
B.溶液中的c(H+)
C.醋酸的电离平衡常数
D.溶液中的c(OH-)
4、选择题 在0.1 mol·L-1 CH3COOH溶液中存在如下电离平衡:CH3COOH  ?CH3COO-+H+对于该平衡,下列叙述正确的是
?CH3COO-+H+对于该平衡,下列叙述正确的是
A.加入水时,平衡向逆反应方向移动
B.加入少量NaOH固体,平衡向正反应方向移动
C.加入少量0.1 mol·L-1 HCl溶液,溶液中c(H+)减小
D.加入少量CH3COONa固体,平衡向正反应方向移动
5、选择题 向三份0.lmol/L NaHCO3溶液中分别加入少量冰醋酸、Ca(OH)2、NaA1O2固体(忽略溶液体积变化),则溶液中CO32-浓度的变化依次为(?)
A.减小、减小、增大
B.减小、增大、增大
C.增大、减小、减小
D.减小、减小、减小