1、填空题 FeCl3溶液中,加入难溶于水的CaCO3粉末,观察到CaCO3逐渐溶解,产生无色气体和红褐色沉淀。则:
(1)气体为___,红褐色沉淀为____。
(2)上述现象产生的理由是___。
参考答案:(1)CO2 ;Fe( OH)3
(2) FeCl3在溶液中水解呈酸性:Fe3+ +3H2O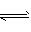 Fe(OH)3+3H+:
Fe(OH)3+3H+:
加入CaCO3逐渐与H+反应:CaCO3+2H+=Ca2++ H2O+CO2↑;消耗H+使Fe3+水解平衡向右移而出现红褐色沉淀
本题解析:
本题难度:简单
2、选择题 工业品MnCl2溶液中含有Cu2+、Pb2+等离子,加入过量难溶电解质MnS,可使Cu2+、Pb2+等离子形成沉淀,以制取纯净MnCl2.由此可推知MnS( )
A.具有吸附性
B.溶解度小于CuS、PbS
C.溶解度与CuS、PbS相同
D.溶解度大于CuS、PbS
参考答案:解;工业品MnCl2溶液中含有Cu2+、Pb2+等离子,加入过量难溶电解质MnS,可使Cu2+、Pb2+等离子形成沉淀,以制取纯净MnCl2,原理利用的是沉淀转化的反应关系,沉淀转化的条件是向更难溶的方向进行,说明生成的CuS、PbS溶解性小于MnS;才能是先沉淀的转化,除去杂质;
故选D.
本题解析:
本题难度:一般
3、选择题 硫酸锶(SrSO4)在水中的溶解平衡曲线如图。下列说法正确的是( )

A.温度一定时,Ksp(SrSO4)随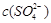 的增大而减小
的增大而减小
B.三个不同温度中,313K时Ksp(SrSO4)最大
C.283K时a点对应的溶液是不饱和溶液
D.283K下SrSO4饱和溶液升温到363K后变为不饱和溶液
参考答案:BC
本题解析:溶度积常数只与温度有关,A错误。根据图像可判断,当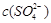 相同时,温度为313K时锶离子的浓度最大,因此选项B正确。A点不位于溶解度曲线上,所以是不饱和溶液,C正确。因为当
相同时,温度为313K时锶离子的浓度最大,因此选项B正确。A点不位于溶解度曲线上,所以是不饱和溶液,C正确。因为当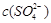 相同时,温度为363K时锶离子的浓度最小,所以283K下SrSO4饱和溶液升温到363K后将有晶体形成,溶液还是饱和溶液。答案选BC。
相同时,温度为363K时锶离子的浓度最小,所以283K下SrSO4饱和溶液升温到363K后将有晶体形成,溶液还是饱和溶液。答案选BC。
本题难度:简单
4、填空题 (共8分)
(1)物质的量浓度相同的①氨水;②氯化铵;⑧碳酸氢铵;④硫酸氢铵;⑤硫酸铵5种溶液中c(NH4+)的大小顺序是______,溶液pH的大小顺序是______。
(2)CO2在自然界循环时可与CaCO3反应,CaCO3是一种难溶物质,其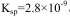 ..CaCl2溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为
..CaCl2溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为 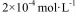 ,则生成沉淀所需CaCl2溶液的最小浓度为 。
,则生成沉淀所需CaCl2溶液的最小浓度为 。
(3)己知: 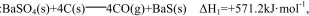
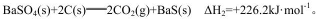
则反应 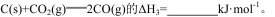
参考答案:每空2分,共8分
(1)⑤>④>②>③>① ①>③>②>⑤>④
(2) 5.6×10-5mol·L-1 (3) +172.5
本题解析:(1)一水合氨是弱电解质,在水溶液中部分电离,所以浓度相同的这几种溶液中,氨水的铵根离子浓度最小,硫酸铵中铵根离子个数是2,所以硫酸铵中铵根离子浓度最大,碳酸氢根离子促进铵根离子水解、氢离子抑制铵根离子水解,所以氯化铵、碳酸氢铵、硫酸氢铵中铵根离子浓度大小顺序是④>②>③,则相同浓度的这几种溶液中c(NH4+)的由大到小顺序是⑤>④>②>③>①;一水合氨是弱碱,溶液呈碱性,溶液碱性最强;硫酸氢铵溶液为强酸性溶液,pH最小,碳酸氢根离子促进铵根离子水解,硫酸铵中铵根离子水解个数大于氯化铵,所以相同浓度的这几种溶液中,溶液pH的由大到小顺序是①>③>②>⑤>④;
(2)根据反应Ca2++CO32-=CaCO3,C(Ca2+)·C(CO32-)=2.8×10-9,C(Ca2+)= 2.8×10-9/1=2.8×10-9mol/L,由于是等体积的CaCl2溶液与Na2CO3溶液混合,所以生成沉淀所需CaCl2溶液的最小浓度为2.8×10-9mol/L×2=5.6×10-5mol·L-1 ;
(3)根据盖斯定律,(△H1-△H2)÷2=(+571.2-226.2)÷2=+172.5。
考点:考查盐类水解,PH值的大小比较,沉淀溶解平衡的应用,盖斯定律的应用等知识。
本题难度:一般
5、填空题 (14分)工业上通常用下列方法治理含氮化合物的污染。
(1)用稀土等催化剂能将汽车尾气中的CO、NOx、碳氢化合物转化成无毒物质,从而减少汽车尾气污染。已知:
①N2(g)+ O2(g)=2NO(g) △H=+180.5 kJ/mol ②2C(s)+ O2(g)=2CO(g) △H=—221.0 kJ/mol
③C(s)+ O2(g)=CO2(g) △H=—393. 5 kJ/mol
写出NO(g)与CO(g)催化转化成N2(g)和CO2(g)的热化学方程式 。
(2)用NH3还原NOx生成N2和H2O。现有NO、NO2的混合气3 L,可用同温同压下3.5 L的NH3恰好使其完全转化为N2,则原混合气体中NO和NO2的物质的量之比为 。
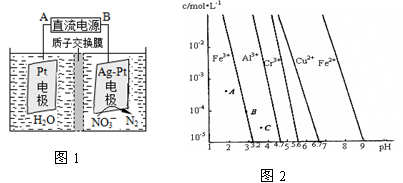
(3)电化学降解治理水中硝酸盐污染。在酸性条件下,电化学降解NO的原理如图1,A为电源的 极,阴极反应式为 。
(4)通过控制溶液的pH对工业废水中的金属离子进行分离。图2是某些金属氢氧化物在不同浓度和pH时的沉淀——溶解图像,图中直线上的点表示平衡状态。当溶液中的离子浓度小于1×10-5 mol·L-1时,认为该离子沉淀完全。
①Fe (OH)3、Al(OH)3、Cr(OH)3三种物质的溶度积常数最大的是 ,
图中A、B、C三点中表示Fe(OH)3的沉淀速率大于溶解速率的是 。
②由图可得Fe(OH)2的溶度积的值为 。
参考答案:(1)2NO(g)+2CO(g)=N2(g)+2CO2(g);ΔH=-746.5KJ/mol;(2) 1:3;(3)正极;2NO3-+12H++10e-=N2↑+6H2O;(4) ①Cr(OH)3、C ;②1×10-15。
本题解析:③×2-②-①,整理可得:2NO(g)+2CO(g)=N2(g)+2CO2(g);ΔH=-746.5KJ/mol;(2)用NH3还原NOx生成N2和H2O。现有NO、NO2的混合气3 L,可用同温同压下3.5 L的NH3恰好使其完全转化为N2,在反应中化合价升降总数相等,3×2x=3.5×3,解得x=1.75.设原混合气体中NO和NO2的物质的量之比为m:n,则(m+2n)÷(m+n)= 1.75,m:n="1:3" ;(3)电化学降解治理水中硝酸盐污染。在酸性条件下,电化学降解NO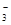 在Ag—Pt电极上得到电子被还原变为N2,所以该电极是阴极,B是电源的负极,则A为电源的正极,阴极反应式为2NO3-+12H++10e-=N2↑+6H2O;(4)①Fe (OH)3、Al(OH)3、Cr(OH)3三种物质的组成结构相同,当溶液中金属离子浓度相同时,哪种微粒的溶液中c(OH-)越大,则根据沉淀溶度积常数Ksp=c(M3+)·c3(OH-)的定义可知哪种金属沉淀物的溶度积常数就越大,画一条离子浓度小于1×10-5 mol/L的水平线,会发现:Cr(OH)3的c(OH-)最大,因此Fe (OH)3、Al(OH)3、Cr(OH)3三种物质的溶度积常数最大的是Cr(OH)3;图中A在沉淀溶解平衡先下侧,还没有达到沉淀溶解平衡,溶解速率大于沉淀速率,物质在不断的溶解;B点处于沉淀溶解平衡中,沉淀速率等于溶解速率,C点处于过饱和状态,沉淀速率大于溶解速率。因此A、B、C三点中表示Fe(OH)3的沉淀速率大于溶解速率的是C点;②由图可得Fe(OH)2的溶度积的值为Ksp(Fe(OH)2)= c(Fe2+)·c2(OH-) =1×10-5× (1×10-5)2 = 1×10-15。
在Ag—Pt电极上得到电子被还原变为N2,所以该电极是阴极,B是电源的负极,则A为电源的正极,阴极反应式为2NO3-+12H++10e-=N2↑+6H2O;(4)①Fe (OH)3、Al(OH)3、Cr(OH)3三种物质的组成结构相同,当溶液中金属离子浓度相同时,哪种微粒的溶液中c(OH-)越大,则根据沉淀溶度积常数Ksp=c(M3+)·c3(OH-)的定义可知哪种金属沉淀物的溶度积常数就越大,画一条离子浓度小于1×10-5 mol/L的水平线,会发现:Cr(OH)3的c(OH-)最大,因此Fe (OH)3、Al(OH)3、Cr(OH)3三种物质的溶度积常数最大的是Cr(OH)3;图中A在沉淀溶解平衡先下侧,还没有达到沉淀溶解平衡,溶解速率大于沉淀速率,物质在不断的溶解;B点处于沉淀溶解平衡中,沉淀速率等于溶解速率,C点处于过饱和状态,沉淀速率大于溶解速率。因此A、B、C三点中表示Fe(OH)3的沉淀速率大于溶解速率的是C点;②由图可得Fe(OH)2的溶度积的值为Ksp(Fe(OH)2)= c(Fe2+)·c2(OH-) =1×10-5× (1×10-5)2 = 1×10-15。
考点:考查盖斯定律的应用、氧化还原反应中的计算、电化学的应用、沉淀溶解平衡的影响因素的知识。
本题难度:困难