1、实验题 (8分)实验室利用如右图装置进行中和热的测定.请回答下列问题:
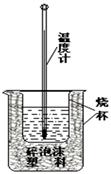
(1)该图中有两处未画出,它们是?、?.
(2)在操作正确的前提下,提高中和热测定准确性的关键是?.
(3)做一次完整的中和热测定实验,温度计需使用_______次.
参考答案:(1)环形玻璃棒?烧杯上方的泡沫塑料盖
(2)提高装置的保温效果?(3)3
本题解析:略
本题难度:简单
2、实验题 (12分)某学生在实验室测定一未知浓度的稀盐酸,已知在25ml氢氧化钠标准溶液中逐滴加入0.2mol/L醋酸溶液的PH变化曲线如图所示:
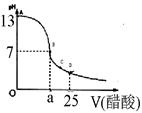
(1)该氢氧化钠溶液的物质的量浓度为??mol.L—1
(2)在B点,a?12.5ml(填“>”、“<”或“="”" )。
(3)配制100 mL NaOH标准溶液所需仪器除托盘天平、玻璃棒、胶头滴管外,还需要?
(4)用?量取20.00 mL待测稀盐酸溶液放入锥形瓶中,并滴加2~3滴酚酞作指示剂,用NaOH标准溶液进行滴定。为了减小实验误差,该同学一共进行了三次实验,假设每次所取稀盐酸体积均为20.00 mL,三次实验结果记录如下:
实验次数
| 第一次
| 第二次
| 第三次
|
消耗NaOH溶液体积/mL
| 19.00
| 23.00
| 23.02
|
该盐酸的浓度约为___________________ (保留两位有效数字)。
滴定达到终点的标志是??
参考答案:(共12分)
(1)0.1mol/L?(2)>?(3)烧杯、100mL容量瓶(答对一个得1分)
(4)酸式滴定管? 0.12 mol·L—1?最后一滴氢氧化钠溶液加入,溶液由无色恰好变成浅红色,半分钟内不褪色
本题解析:略
本题难度:简单
3、实验题 为了粗略测定电石中碳化钙的质量分数,某研究性学习小组设计了如下图所示的制气与除杂装置。请参与研究并回答相关问题:
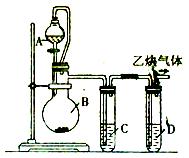
(1)写出烧瓶B中发生反应的 化学方程式:__________________________。
化学方程式:__________________________。
(2)漏斗与烧瓶之间用玻璃导管连接,其目的是_____________________________________。
(3)试管中装有同一种蓝色溶液,该溶液是____________,其中试管C的作用是_______________________,试管D的作用是____________ ____________。
____________。
(4) 为了测量产生的乙炔气体的体积,该小组同学设计了下图所示的两种装置。则应选择装置_______
为了测量产生的乙炔气体的体积,该小组同学设计了下图所示的两种装置。则应选择装置_______ __(填Ⅰ或Ⅱ)。
__(填Ⅰ或Ⅱ)。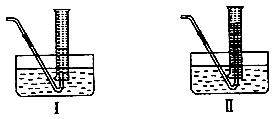
参考答案:(1)CaC2 +2H2O----Ca(OH)2 + C2H2
(2)使 漏斗内的压强与烧瓶内的压强相等,有利于漏斗中的水滴下。
漏斗内的压强与烧瓶内的压强相等,有利于漏斗中的水滴下。
(3)CuSO4溶液,除去杂质气体H2S;检验杂质气体H2S是否已除尽
本题解析:略
本题难度:一般
4、填空题 (10分)某研究性学习小组对铝热反应实验 展开研究。现行高中化学教材中对“铝热反应”的现象有这样的描述:“反应放出大量的热,并发出耀眼的光芒”、“纸漏斗的下部被烧穿,有熔融物落入沙中”。查阅《化学
展开研究。现行高中化学教材中对“铝热反应”的现象有这样的描述:“反应放出大量的热,并发出耀眼的光芒”、“纸漏斗的下部被烧穿,有熔融物落入沙中”。查阅《化学 手册》知,Al、Al2O3、Fe、Fe2O3熔点、沸点数据如下:
手册》知,Al、Al2O3、Fe、Fe2O3熔点、沸点数据如下:
物质
| Al
| Al2O3
| Fe
| Fe2O3
|
熔点/℃
| ? 660?
| 2054
| 1535
| 1462
|
沸点/℃
| 2467
| 2980
| 2750
| -
|
I.?⑴某同学推测,铝热反应所得到的熔融物应是铁铝合金。理由是:该反应放出的热量使铁熔化,而铝的熔点比铁低,此时液态的铁和铝熔合形成铁铝合金。你认为他的解释是否合理?答:_________________(填“合理”或“不合理)
⑵设计一个简单的实验方案,证明上述所得的块状熔融物中含有金属铝。该实验所用试是_______________。
⑶实验室溶解该熔融物,下列试剂中最好的是____________ (填序号)。
(填序号)。
A.浓硫酸? B.稀硫酸? C.稀硝酸? D.氢氧化钠溶液
II.实验研究发现,硝酸发生氧化还原反应时,硝酸的浓度越稀,对应还原产物中氮元素的化合价越低。某同学取一定量上述的熔融物与一定量很稀的硝酸充分反应,反应过程中无气体放出。在反应结束后的溶液中,逐滴加入4mol·L-1的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生的沉淀的物质的量(mol)的关系如图所示。试回答下列问题:
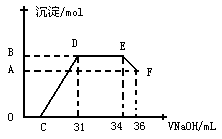
⑴图中OC段没有沉淀生成,此阶段发生反应的化学方程式为__________________________________。
⑵在DE段,沉淀的物质的量没有变化,则此阶段发生反应的离子方程式是
_______________?_______;
上述现象说明溶液中________?_________结合OH-的能力比_______强(填离子符号)。
(3) B与A的差值为_________mol。B点 对应的沉淀的物质的量为________mol,C点对应的氢氧化钠溶液的体积为___________mL
对应的沉淀的物质的量为________mol,C点对应的氢氧化钠溶液的体积为___________mL
参考答案:
本题解析:略
本题难度:简单
5、实验题 某化学课外小组用如图所示装置制取溴苯。先向分液漏斗中加入苯和液溴,再将混合液慢慢滴入反应器A(A下端活塞关闭)中。
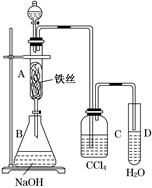
(1)写出A中反应的化学方程式________________。
(2)观察到A中的现象是____________________________________。
(3)实验结束时,打开A下端的活塞,让反应液流入B中,充分振荡,目的是________________,写出有关的化学方程式___________________。
(4)C中盛放CCl4的作用是____________________。
(5)若证明苯和液溴发生的是取代反应,而不是加成反应,可向试管D中加入AgNO3溶液,若产生淡黄色沉淀,则能证明。另一种验证的方法是向试管D中加入__?_,现象是_______________________ 。
参考答案:(10分)(1) 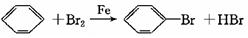
(2)反应液微沸,有红棕色气体充满A容器?(3)除去溶于溴苯中的溴
Br2+2NaOH=NaBr+NaBrO+H2O 或? 3Br2+6NaOH=5NaBr+NaBrO3+3H2O
(4)除去溴化氢气体中的溴蒸气?(5)石蕊试液 溶液变红色(其他合理答案都对)
本题解析:(1)装置A中用来制备溴苯的,所以A中反应的化学方程式是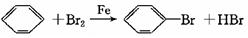 。
。
(2)由于该反应是放热反应,且单质溴易挥发,所以实验中观察到的实验现象是反应液微沸,有红棕色气体充满A容器。
(3)由于生成的溴苯中含有溶解的单质溴,所以让反应液流入氢氧化钠溶液中的目的是除去溶于溴苯中的溴,有关反应的方程式是Br2+2NaOH=NaBr+NaBrO+H2O,或3Br2+6NaOH=5NaBr+NaBrO3+3H2O。
(4)由于单质溴易挥发,会干扰溴化氢的检验,所以四氯化碳的作用是除去溴化氢气体中的溴蒸气。(5)由于溴化氢溶于水溶液显酸性,据此可以检验,即向试管D中加入石蕊试液,而实验现象是溶液变红色。
点评:该题是高考中的常见题型,属于中等难度的试题。试题贴近高考,针对性强,主要是考查学生对溴苯制备原理、物质的除杂、物质的检验的了解掌握情况,有助于培养学生规范严谨的实验设计能力,有利于提高学生的应试能力,有助于提升学生的学科素养。
本题难度:一般