|
高考化学必考知识点《探究性实验的设计与评价》考点巩固(2019年最新版)(四)
2019-07-03 23:03:25
【 大 中 小】
|
1、实验题 某校三个研究性学习小组对“葡萄糖溶液与新制的氢氧化铜悬浊液作用得到的砖红色沉淀是Cu2O”提出质疑。
(1)甲小组认为红色沉淀不一定是Cu2O,为此展开了确定红色沉淀成分的研究。
步骤一:提出假设::?。
步骤二:查阅资料。得出:① +1价的铜在酸性条件下易发生自身氧化还原反应;
② 在空气中灼烧氧化亚铜生成氧化铜。
步骤三:设计方案、实验。
A.取该红色沉淀溶于足量的稀硝酸中,观察溶液颜色变化
B.取该红色沉淀溶于足量的稀硫酸中,观察是否有残渣
C.取该红色沉淀ag,在空气中充分灼烧至完全变黑,放在干燥器里冷却,
再称重,反复多次至固体恒重,称得质量为bg,比较a,b的关系
D.取该红色沉淀装入试管里,加入酸化的硝酸银溶液,观察是否有银白色
| 沉淀析出。
你认为合理的方案是(填字母)?。
(2)乙小组针对甲小组的假设,另设计如如下图装置进行验证。
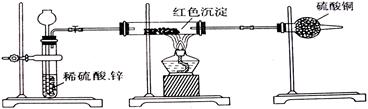
若按乙组装置定性检验上述红色沉淀成分,可根据?现象的发生与否即可判断。
若按乙组装置定量测定上述红色沉淀的成分,你认为理论上应该测定下列哪些物理量?(填序号)。
①通入氢气的体积;②反应前红色沉淀和硬质玻管的总质量;③完全反应后红色固体和硬质玻璃管的总质量;④实验前干燥管质量;⑤硬质玻璃管质量;⑥锌粒质量;⑦稀硫酸中含溶质的量;⑧实验后干燥管质量
该实验装置中距实际可行性方面存在的缺陷有?
?(请写出两点)。
参考答案:(1)假设①:红色沉淀成分为Cu;假设②:红色沉淀成分为Cu2O;假设③:红色沉淀成分为Cu和Cu2O。(答出任一假设得2分)? C?(2分)
(2)硬质玻管有水或干燥管内白色粉末变蓝(2分)②③⑤(3分,错或漏一个扣1分,错或漏2个0分) 从发生装置产生的氢气中含有水、硬质玻管内水分很难全部被潮湿堤氢气赶尽、外界空气中的水蒸气也会被无水硫酸铜吸收等考虑(答出1点给1分,答出2点给3分)
本题解析:
(1)?由于Cu、Cu2O都为红色,所以将产生三种可能:Cu、Cu与Cu2O、Cu2O
A.取该红色沉淀溶于足量的稀硝酸中,观察溶液颜色变化,该方法最终固体都将全部溶解,溶液变成兰色。
B.取该红色沉淀溶于足量的稀硫酸中,观察是否有残渣,以上三种可能不管那一种用该方法最终都会有残渣
D.取该红色沉淀装入试管里,加入酸化的硝酸银溶液,观察是否有银白色沉淀析出。以上三种可能不管那一种用该方法都会产生Cu,最终都会置换出银。
(2)?氢气如果还原Cu2O则有水生成,硬质玻管有水或干燥管内白色粉末变蓝
只要有②③⑤就可以用差量法和极值法计算出结果
?从发生装置产生的氢气中含有水、硬质玻管内水分很难全部被潮湿的氢气赶尽、外界空气中的水蒸气也会被无水硫酸铜吸收等考虑
本题难度:一般
2、实验题 (20分)某研究性学习小组请你参与“研究铁与水反应所得固体物质的成分、性质及再利用”实验探究,并共同解答下列问题:
【探究一】设计右图所示装置进行“铁与水反应”的实验。
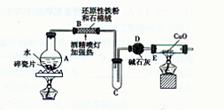 ? ?
(1)硬质试管中发生反应的化学方程式为?。
(2)反应前A中投放碎瓷片的目的是?。
(3)装置E中的现象是?。
【探究二】设计如下实验方案确定反应后硬质玻璃管中黑色固体的成分。
(4)待硬质试管B冷却后,取少许其中的固体物质溶于?后,将所得溶液分成两份。
(5)一份滴加几滴KSCN溶液。若溶液变红色,推断硬质玻璃管B中固体物质的成分(选填序号,下同)?。;若溶液未变红色,推断硬质玻璃管B中固体物质的成分
①一定有Fe3O4,可能有Fe?②Fe3O4和Fe?③只有Fe3O4?④只有Fe
(6)另一份用___?(填仪器名称)加入?,可以证明溶液中存在Fe2+。
【探究三】设计如下流程利用上述滤液制取绿矾晶体(FeSO4·7H2O)。
滤液 FeSO4溶液 FeSO4溶液 FeSO4·7H2O晶体 FeSO4·7H2O晶体
(7)步骤I中加入洁净废铁屑的作用是?(用化学方程式表示)。
(8)步骤II从FeSO4稀溶液中得到FeSO4·7H2O晶体的主要操作包括?、趁热过滤____、再过滤。为防止FeSO4变质,该流程中还需注意的问题有?。
【探究四】设计如下流程测定反应后硬质玻璃管B中固体含铁元素的质量分数。
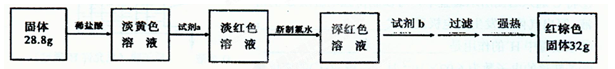
(9)试剂b的化学式是?____。
(10)计算反应后B装置中铁元素的质量分数为?;根据计算结果判断反应后硬质试管B中固体物质的成分是?。
?
参考答案:

本题解析:略
本题难度:简单
3、填空题 室温下,将一定浓度的Na2CO3溶液滴入CuSO4溶液中得到了蓝色沉淀。为了确定沉淀的组成,某研究性学习小组进行了以下试验和研究。
(一)【提出假说】
假设一:两者反应只生成CuCO3沉淀;
假设二:两者反应只生成Cu(OH)2沉淀;
 假设三:?; 假设三:?;
(二)【理论探究】
查阅资料:CuCO3和Cu(OH)2均不带结晶水;
KSP〔CuCO3〕=1.4×10-10? KSP〔Cu(OH)2〕=5.6×10-20
若只由此数据结合适当计算来判断,假设?是正确的。
(三)【实验探究】
步骤一:将CuSO4溶液倒入等浓度等体积的Na2CO3溶液中并搅拌,有蓝色沉淀生成。
步骤二:将沉淀从溶液中分离出来,其操作方法为:①过滤 ,②?,③干燥。?
步骤三:利用下图所示装置,进行定量分析:
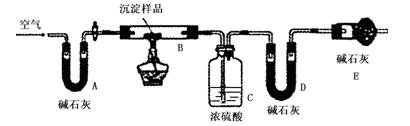
① A装置中玻璃仪器的名称是?。
② 仪器组装好后首先要进行的实验操作是?。
③ 实验结束时通入过量的空气的作用是 ?。
④ 数据记录:
?
| B装置的质量(g)
| C装置的质量(g)
| D装置的质量(g)
| 实验前
| 15.4
| 262.1
| 223.8
| 试验后
| 6.1
| 264.8
| 230.4
|
(四)【实验结论】
利用上述数据初步判断该沉淀的成分是CuCO3和Cu(OH)2,在沉淀中二者的物质的量之比为?。若所得沉淀是纯净物而不是混合物,请写出该物质的化学式?。
参考答案:(一)uCO3和Cu(OH)2的混合物[2分。如果答Cu2(OH)2CO3或与前两种任一组合均给分。]?二 (2分)
(三) 步骤二:洗涤(1分)
步骤三:① U 形管 (1分。答干燥管或干燥器不给分。)
②检查装置的气密性 (2分)
③保证装置中的水蒸气和CO2被C、D装置完全吸收(3分。只要涵义表达清楚即给3分)
(四)1﹕1(3分)。 Cu2(OH)2CO3(2分。或CuCO3?Cu(OH)2或Cu(OH)2?CuCO3或写成化学式的形式均给2分)
本题解析:略
本题难度:一般
4、实验题 (14分)
某校化学兴趣小组设计了图示实验装置(图中省略了夹持仪器)来测定某铁碳合金中铁的质量分数。
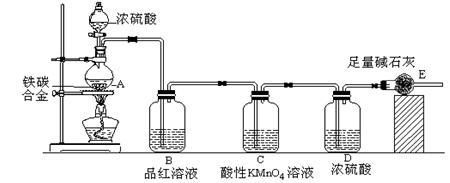
⑴ m克铁碳合金中加入过量浓硫酸,未点燃酒精灯前,A、B均无明显现象,其原因是
①常温下碳与浓硫酸不反应;②?。
⑵写出加热时A中碳与浓硫酸发生反应的化学方程式?。
⑶B中的现象是:?;C的作用是:?。
⑷待A中不再逸出气体时,停止加热,拆下E并称重,E增重bg。则铁碳合金中铁的质量分数为??(写表达式)。
⑸甲同学认为利用此装置测得铁的质量分数偏大,请你写出可能的原因:?。
⑹最后对所得测量结果进行评价,小组内有同学提出,本套装置在设计上存在多处缺陷而导致实验结果不准确,其中会导致铁质量分数测量值偏低是(任答一条即可)?。
参考答案:(共14分)
△
本题解析:略
本题难度:一般
5、填空题 为了制得氯气并探究氯气的一些化学性质,某学生用如图所示装置进行有关实验,打开A的玻璃塞,将A中浓盐酸溶液逐滴加入装有二氧化锰的B中。试回答:
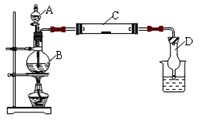
(1)怎样检验装置的气密性??;
(2)若C中为淀粉KI试纸,实验片刻后C中可以观察到的实验现象为?;写出
B中发生反应的离子方程式?。
(3)若C中的淀粉KI试纸实验一段时间后又变为无色,原因是?。
(4)D的作用是_______________。烧杯中加入的是??。
(5)若实验室暂时无二氧化锰,仍用此装置制取氯气,选用?药品替代。若实验室暂时无浓盐酸,仍用此装置制取氯气,选用?药品替代。
参考答案:(12分)(1)关闭分液漏斗,对烧瓶进行微热,看烧杯中是否有气泡产生,冷却后D中是否产生水柱。(2分)
(2)试纸变蓝色(1分)。MnO2 +2Cl- +4H+ ? ?Mn2+? +Cl2↑ +2H2O(2分) ?Mn2+? +Cl2↑ +2H2O(2分)
(3)将KI氧化成KIO3 (2分)
(4)防倒吸(1分)氢氧化钠溶液(1分)
(5)KMnO4、KClO3(合理 给分)(2分);NaCl和浓硫酸(1分) 给分)(2分);NaCl和浓硫酸(1分)
本题解析:略
本题难度:一般
| 