1、填空题 (每空1分共5分)
(1)常温下,0.05mol/L硫酸溶液中,c(H+)=?mol/L,pH值为?,水电离的c(H+)=?mol/L
(2)某温度下,纯水中c(H+)=2×10-7mol/L,则纯水中c(OH-)=?mol/L,滴入盐酸使c(H+) ="5" ×10-6mol/L,则c(OH-) =_________mol/L
2、选择题 下列分别是利用不同能源发电的实例图形,其中不属于新能源开发利用的是
3、填空题 测定石灰石中钙元素的质量百分含量时,都是先把钙元素全部转化为草酸钙沉淀 (CaC2O4?H2O),然后将草酸钙沉淀 (CaC2O4?H2O),用硫酸溶解,用a mol/L的标准高锰酸钾溶液滴定生成的草酸,发生化学反应:H2C2O4 + MnO4- + H+ ?→? Mn2+ + CO2? ↑+ H2O(未配平)。
(1)配平后离子方程式的系数依次为?、?、?、?、?、?。
(2)实验前,首先要精确配制一定物质的量浓度的KMnO4溶液250mL,配制时需要的仪器除天平、玻璃棒、烧杯、250mL容量瓶外,还需?。
(3)上述实验中的KMnO4溶液需要酸化,不能使用盐酸酸化的原因是?。
(4)开始取用样品的质量为m g,硫酸溶解后所得草酸溶液的体积为100mL,每次取25.00mL进行滴定,达到滴定终点时所耗KMnO4溶液体积为 b mL,所得草酸溶液的物质的量的浓度是?;石灰石中钙元素的质量百分含量为?。(相对原子质量:Ca—40)
4、选择题 下列微粒表示正确且能促进H2O的电离的是
A.2H+
B.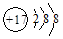
C.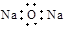
D.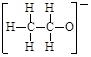
5、填空题 按要求回答下列问题
(1)某温度下,纯水中c (H+)=2.0×10-7 mol·L-1,则此时c (OH-) =?mol·L-1
0.9mol·L-1NaOH溶液与0.1mol·L-1HCl溶液等体积混合(不考虑溶液体积变化)后,溶液的pH=_____。
(2)向0.020 mol·L-1的HCN溶液中加入0.020 mol NaCN固体,溶液pH增大,主要原因是?;已知该混合溶液中c (Na+) > c (CN-),则c (HCN)?c (CN-)(用“>”、“<”、“=”符号填空)。
(3)向1L 0.10 mol·L-1的HCN溶液中加入0.08molNaOH固体,得到混合溶液,则_________和__________两种粒子的物质的量之和等于0.1mol;写出该混合溶液中存在的所有平衡的表达式?。