1、实验题 ( 12分 ) 如图所示的装置用于制备1,2 -二溴乙烷 ( 广口瓶中的NaOH溶液是为了吸收副反应产生的SO2等 ) ,请回答下列问题:
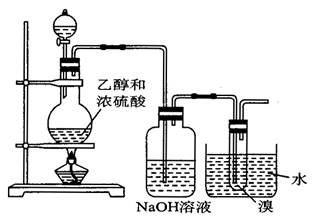
( 1 ) 加热混合物至170 ℃ 左右是为了 ____________________ 。
( 2 ) 广口瓶中NaOH溶液过量,写出吸收SO2反应的化学方程式 ___________________ 。
( 3 ) 使用水作冷却剂是为了什么?
( 4 ) 烧瓶中的混合液加热时先变棕色后变黑色是由于 _________________________ 。
( 5 ) 烧瓶中放些白瓷片,其作用是什么?
( 6 ) 生成的1,2 -二溴乙烷通常混有过量的溴,为洗去溴最好用 ______________ 。
参考答案:( 1 ) 制乙烯
? ( 2 ) SO2 + 2NaOH══Na2SO3 + H2O
? ( 3 ) 防止溴挥发
? ( 4 ) 浓H2SO4使部分乙醇氧化为碳
? ( 5 ) 防止暴沸
? ( 6 ) NaOH溶液
本题解析:该题是对实验室制乙烯的考查,原理:CH3CH2OH 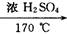 ?CH2═CH2↑ + H2O,存在的副反应有①浓H2SO4使乙醇脱水碳化,并发生2H2SO4 ( 浓 ) + C══2SO2↑ + CO2↑ + 2H2O反应,②CH3CH2OH + HO—CH2CH3
?CH2═CH2↑ + H2O,存在的副反应有①浓H2SO4使乙醇脱水碳化,并发生2H2SO4 ( 浓 ) + C══2SO2↑ + CO2↑ + 2H2O反应,②CH3CH2OH + HO—CH2CH3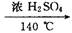 CH3CH2—O—CH2CH3 ( 乙醚 ) + H2O,所以必须控制温度在170 ℃,该题还考查了乙烯性质的验证:CH2═CH2
CH3CH2—O—CH2CH3 ( 乙醚 ) + H2O,所以必须控制温度在170 ℃,该题还考查了乙烯性质的验证:CH2═CH2 
本题难度:简单
2、选择题 能证明土豆中含有淀粉的试剂是( )
A.淀粉-碘化钾试纸
B.银氨溶液
C.碘水
D.碘化钾
参考答案:A、淀粉-碘化钾试纸中不含碘单质,不能检验淀粉,可以检验强氧化性物质,故A错误;
B、淀粉属于多糖,不能发生银镜反应,含有醛基的物质可以发生银镜反应,不能用银氨溶液检验淀粉,故B错误;
C、淀粉遇碘会变蓝色,可以用碘水检验土豆中含有淀粉,故C正确;
D、碘化钾中的碘元素不是碘单质,是碘离子,碘离子不能使淀粉变蓝色,故D错误;
故选C.
本题解析:
本题难度:简单
3、实验题 (16分)溴水和氯化铁溶液均是中学化学实验中的常用试剂,浓度较小时,溶液均呈黄色。在探究铁的化合物相互转化时,进行下列实验。
实验操作:向足量20 mL的FeSO4溶液中,滴入几滴浓溴水,振荡。
实验现象:溶液由浅绿色变成黄色。
(1)对该实验现象的解释:
①如果发生了化学反应,则使溶液呈黄色的微粒是?(填化学式,下同);
②如果未发生化学反应,则使溶液呈黄色的微粒是?。
(2)通过进一步实验,可证明Br2水和FeSO4溶液是否发生反应。下列是设计的一些实验方案和预测。请填空:
?
| 操作
| 预期现象及结论
|
方案1
| 取少量黄色溶液,加入NaOH溶液
| 如果生成红褐色沉淀,则说明发生了反应
|
方案2
| 取少量黄色溶液,加入淀粉碘化钾溶液
| 如果溶液变蓝色,则说明未发生反应
|
方案3
| 取少量黄色溶液,加入四氯化碳,振荡
| 如果下层溶液呈橙红色,则说明:
?
|
①方案1是否合理??(填“合理”或“不合理”)。
方案2中,由于存在反应?(用离子方程式表示),所以预测结论不正确。
②请你另外设计一个合理方案,证明已经反应。将有关内容填入下表。
实验操作
| 预期现象及结论
| 解释现象的离子方程式
|
?
| ?
| ?
参考答案:(16分)
(1)①Fe3+?(2分)?②Br2?(2分)
(2)未发生反应(2分)
①不合理?(2分)? 2 Fe3+ + 2 I-="=" 2 Fe2+?+ I2?(2分)
②(6分)
实验操作
预期现象及结论
解释现象的离子方程式
取少量黄色溶液,
滴加KSCN溶液
溶液变为红色,则说明发生了反应
Fe3++ 3SCN-=Fe(SCN)3
本题解析:略
本题难度:一般
4、简答题 化学实验是科学探究的基础.请回答有关实验问题:
(1)下面的四个实验装置有三个都存在明显缺陷,其中完全正确的是______:
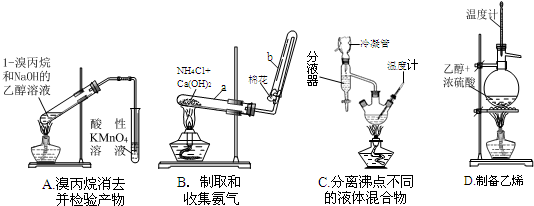
(2)要检验上面B装置氨气已集满的操作是______则试管已集满.
(3)ClO2是一种安全、高效、广谱、强力杀菌剂,其性质如表:
| 色态 | 溶于碱 | 超过1Kpa、受热或遇光
常温气体
-59-11℃
红黄色液体
生成亚氯酸盐和氯酸盐
爆炸
|
①由表可以看出:保存液态ClO2的条件是密封、______;ClO2与碱反应的离子方程式为______;观察“图A”,要从NaClO2溶液制得不含结晶水的晶体,操作是蒸发结晶,控制条件是______;应控制析出晶体的温度范围是______.
②工业用潮湿的KClO3和草酸(H2C2O4)在60℃时反应制得.某学生拟用图B所示装置模拟工业制法制取并收集液态ClO2,请模仿图B的装置图和图例,在答题卡的相应图中补充完善装置图,并作必要的标注.

参考答案:(1)A.加热挥发出的乙醇被酸性高锰酸钾氧化,所以乙醇也能时酸性高锰酸钾溶液褪色,从而导致干扰烯烃的检验,故A错误;
B.实验室用氯化铵和氢氧化钙加热制取氨气,氨气易溶于水,和氧气在常温下不反应,密度小于空气,所以氨气采用向下排空气法收集,故B正确;
C.蒸馏分离混合物时,温度计测量馏分温度而不是混合溶液温度,故C错误;
D.乙醇和浓硫酸在170℃条件下制取乙烯,温度计测量混合溶液温度,故D错误;
故选B;
(2)氨气能使湿润的红色石蕊试纸变蓝色,氨气和氯化氢反应产生白烟,所以可以用浓盐酸或湿润的红色石蕊试纸检验氨气,其检验方法为:取用水湿润的pH试纸(或红色石蕊试纸,或粘有浓氨水的玻棒)靠近b管口,若试纸变红,故答案为:取用水湿润的pH试纸(或红色石蕊试纸,或粘有浓氨水的玻棒)靠近b管口,若试纸变红;
(3)①二氧化氯的熔点较低,易挥发,所以二氧化氯要密封且低温避光保存;
二氧化氯和碱反应生成亚氯酸盐和氯酸盐,同时还生成水,离子反应方程式为2ClO2+2OH-═ClO2-+ClO3-+H2O;
从溶解度曲线可以看出,常压在略高于38℃时蒸发留在母液中的NaClO2太多,只有减压时蒸发,在略高于38℃时水分挥发多一些、母液少一些;
根据图象知,当温度略高于38℃时析出氯酸钠晶体,所以蒸发结晶析出氯酸钠晶体时,温度控制在略高于(或大于)38℃,
故答案为:低温避光;2ClO2+2OH-═ClO2-+ClO3-+H2O;减压蒸发;略高于(或大于)38℃;
②潮湿的KClO3和草酸(H2C2O4)在60℃时反应制得,所以要用温度计控制混合溶液温度,二氧化氯常温下是气体,其熔点较低,要使其变为液体,应该采用冰水混合物冷却,二氧化氯有毒不能直接排空,所以要有尾气处理装置,所以该装置图为 , ,
故答案为: . .
本题解析:
本题难度:一般
5、选择题 符合如下实验过程和现象的试剂组是( )
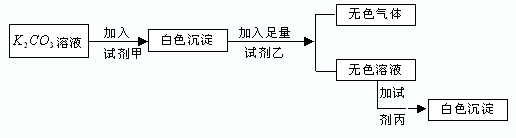
| 甲 | 乙 | 丙
A.MgCl2
HNO3
K2SO4
B.BaCl2
HNO3
K2SO4
C.NaNO3
H2SO4
Ba(NO3)2
D.BaCl2
HCl
CaCl2
|
A.A
B.B
C.C
D.D
参考答案:A.碳酸钾与氯化镁反应生成碳酸镁沉淀,加入硝酸反应生成硝酸镁溶液,加入硫酸钾不反应,故A错误;
B.碳酸钾与氯化钡反应生成碳酸钡沉淀,加入硝酸反应生成硝酸钡溶液,加入硫酸钾生成硫酸钡沉淀,故B正确;
C.碳酸钾与硝酸钾不反应,故C错误;
D.碳酸钾与氯化钡反应生成碳酸钡沉淀,加入盐酸反应生成氯化钡溶液,加入氯化钙不反应,故D错误.
故选B.
本题解析:
本题难度:一般
|