1、实验题 (16分) I、实验室中常以BaSO4重量法测定BaCl2·nH2O中的Ba的含量主要步骤如下:
①?灼烧瓷坩埚至恒重,称得坩埚的质量
② 称取BaCl2·nH2O并在烧杯中溶解,加盐酸处理
③ 将一定浓度的过量硫酸滴入钡盐中得到白色沉淀
④ 静置,?
⑤ 将沉淀和滤纸置于瓷坩埚中,经酒精喷灯加热碳化后,继续在800-850℃灼烧至恒重,称重
⑥ 计算
请回答下列问题:
(1)省略第①步中“灼烧瓷坩埚至恒重”可能导致计算结果_ ______(填“偏高”、“不变”或“偏低”)。
______(填“偏高”、“不变”或“偏低”)。
(2)第④步静置后的操作是?。
(3)第⑤步灼烧温度不超过900℃,是因为_______________________。
II、某同学用氨水吸收一定量的SO2,吸收后溶液中可能含有OH-、SO32-、SO42-、 HSO3- 等阴离子中的若干种。
(4)写出氨水吸收过量SO2的反应的离子方程式:?
(5)已知亚硫酸氢盐一般可溶于水。仅限选择的仪器和试剂:烧杯、试管、玻璃棒、胶头滴管; 2 mol/L盐酸、2 mol/L硝酸、1 mol/L氯化钡溶液、l mol/L氢氧化钡溶液、品红溶液、蒸馏水。请设计实验探究吸收后溶液中是否存在SO32-、HSO3-,将实验操作、预期的实验现象和结论填在下表中。
实验操作
| 预期现象与结论
|
步骤1:取少量待测液放入试管1中,滴加过量lmol/L氯化钡溶液。
| 若不出现浑浊,则溶液中不存在SO32-,
若出现浑浊,则溶液中可能含有SO32-。
|
步骤2:若出现浑浊,静置一段时间后,将上层清液倒入试管2中。往试管1中加入蒸馏水洗涤沉淀,静置后弃去上层清液,再加入?。
| ?
|
步骤3:
| ?
|
?
2、简答题 硝酸铈铵[(NH4)2C他(N手3)6]广泛应用于电子、催化工业,其合成路线如他1:

(1)已知(NH4)2C他(N手3)6受热易分解,某科研小组认为反应原理如下,请补充完整:
(NH4)2C他(N手3)6
C他手2?8手H+8______↑;C他手2?8手HC他手2+4H2手↑+2手2↑.
在空气中加热(NH4)2C他(N手3)6,除固体颜色有变化外,还可观察到的现象是______.
(2)步骤Ⅰ中,将C他(N手3)3?6H2手配成溶液,保持pH到4~5,缓慢加入H2手2溶液搅拌混合均匀,再加入氨水调节溶液pH,得到C他(手H)4沉淀.该过程中参加反应的氧化剂与还原剂物质的量之比为______.
(3)298K时,Ksp[C他(手H)4]=1×10-29.C他(手H)4的溶度积表达式为Ksp=______.为了使溶液中C他4+沉淀完全,即残留在溶液中的c(C他4+)小于1×10-5d手l?L-1,需调节pH为______以3.
(4)为了研究步骤Ⅲ的工艺条件,科研小组测定了(NH4)2C他(N手3)6在不同温度、不同浓度硝酸中的溶解度,结果如他2.从他2中可得出三条主要规律:
①(NH4)2C他(N手3)6在硝酸中的溶解度随温度升高而增大;
②______;
③______.
3、选择题 下列有关实验操作的叙述正确的是(?)
A.用CCl4萃取碘水中的I2时,有机层从分液漏斗的下端放出
B.除去铜器表面的铜绿[Cu2(OH)2CO3]:用盐酸浸泡,再用清水冲洗
C.除去CO2气体中的少量HCl:通入Na2CO3溶液洗气
D.酸碱中和滴定时,锥形瓶需用待测液润洗2次,再加入待测液
4、简答题 【化学与技术】
将磷肥生产中形成的副产物石膏(CaSO4·2H2O)转化为硫酸钾肥料和氯化钙水合物储热材料,无论从经济效益、资源综合利用还是从环境保护角度看都具有重要意义。以下是石膏转化为硫酸钾和氯化钙的工艺流程示意图。
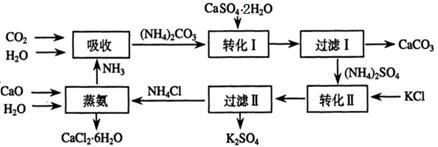
(1)本工艺中所用的原料除CaSO4·2H2O、KCl外,还需要?等原料。
(2)石膏悬浊液中加入碳酸铵溶液后发生反应的离子方程式为?。
(3)过滤Ⅰ操作所得固体中,除CaCO3外还含有?(填化学式)等物质,该固体可用作生产水泥的原料。
(4)检验过滤Ⅰ所得滤液中含有CO32-的方法是?。
(5)氯化钙结晶水合物(CaCl2·6H2O)是目前常用的无机储热材料,选择的依据是?。
a.熔点较低(29℃熔化)? b.能导电? c.能制冷? d.无毒
(6)上述工艺流程中体现绿色化学理念的是?。
5、选择题
①用蒸馏的方法可将海水淡化
②将混合气体通过盛有品红溶液的洗气瓶,可除去CO2中的SO2
③向溶液中滴入盐酸酸化的氯化钡溶液可检验溶液中是否含有SO42—
④向含有Mg(OH)2和Ca(OH)2的浊液中加入足量MgCl2溶液,充分反应后过滤,可除去Ca(OH)2
A.①②
B.①④
C.②③
D.③④