1、选择题 下列叙述正确的是
[? ]
A.配制480 mL 0.1mol/L的CuSO4溶液,应称取胆矾12.5 g
B.将25 g无水CuSO4溶于水制成100L溶液,其浓度为1mol/L
C.将wga%的NaCl饱和溶液蒸发掉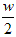 g水, 得到2a%的NaCl溶液
g水, 得到2a%的NaCl溶液
D.将1体积c mol/L的硫酸用水稀释为5体积,稀溶液的浓度为0.2cmol/L
2、简答题 用18mol/L?浓硫酸配制100ml?3.0mol/L?稀硫酸的实验步骤如下:
①计算所用浓硫酸的体积?②量取一定体积的浓硫酸
③溶解?④转移、洗涤?⑤定容、摇匀
回答下列问题
(1)所需浓硫酸的体积是______,量取浓硫酸所用的量筒的规格是______
(从下列中选用?A.10ml?B.20ml?C.50ml?D.100ml)
(2)第③步实验的操作是______.
(3)第⑤步实验的操作是______.
(4)下列情况对所配制的稀硫酸浓度有何影响?(用偏大、偏小、无影响填写)
A.所用的浓硫酸长时间放置在密封不好的容器中______
B.容量瓶用蒸馏洗涤后残留有少量的水______
C.所用过的烧杯、玻璃棒未洗涤______
D.定容时俯视溶液的液凹面______.
3、实验题 实验室要配制1 mol·L-1的稀硫酸250mL,回答下列问题:
(1)需要98%密度为1.84g/cm3的浓硫酸_________mL
(2)配制时,必须使用的仪器有_________(填代号)
①烧杯 ②100 mL量筒 ③20 mL量筒 ④1000 mL容量瓶? ⑤250 mL容量瓶 ⑥托盘天平(带砝码)
⑦玻璃棒
还缺少的仪器是____________。
(3)配制时,该实验两次用到玻璃棒,其作用分别是_________、__________。
(4)配制过程中出现以下情况,对所配溶液浓度有何影响(填“偏高”“偏低”“不影响”)
①没有洗涤烧杯和玻璃棒。________。
②如果加水超过了刻度线,取出水使液面恰好到刻度线。_________。
③容量瓶没有干燥。________。
④定容时俯视容量瓶瓶颈刻度线。_________。
4、选择题 要配制浓度约为2mol/LNaOH溶液100mL,下列操作正确的是( )
A.称取8gNaOH固体,放入100mL量筒中,边搅拌边慢慢加入蒸馏水,待固体完全溶解后用蒸馏水稀释至100mL
B.称取8gNaOH固体,放入100mL容量瓶中,加入适量蒸馏水,振荡容量瓶使固体溶解,再加入水到刻度,盖好瓶塞,反复摇匀
C.称取8gNaOH固体,放入100mL烧杯中,将烧杯中加满蒸馏水,同时不断搅拌至固体溶解
D.用100mL量筒量取40ml5mol/LNaOH溶液,倒入250mL烧杯中,再用同一量筒取60mL蒸馏水,不断搅拌下,慢慢倒入烧杯中
5、简答题 某同学在实验室中称取20gNaOH固体,来配制500mL1mol?L-1的氢氧化钠溶液.
(1)该同学准备的实验用品有:托盘天平(带砝码)、药匙、量筒、玻璃棒等,还缺少的玻璃仪器有______;
(2)下列有关实验操作,正确的是______;
A.称量氢氧化钠固体时,要在天平的左右两个托盘上分别放置大小相同的两片滤纸
B.某同学将称量的氢氧化钠固体溶解并冷却至室温,然后转移到容量瓶中
C.某同学在定容时,不小心加水超过刻度线,又将多余的液体吸出直至刻度线
D.某同学在溶解、转移完氢氧化钠溶液后,将溶解用的仪器洗涤2~3次,并将洗涤液转移到容量瓶中
(3)玻璃棒在该实验中的作用有①______?②______.