|
高考化学知识点总结《原电池原理》高频试题强化练习(2019年最新版)(二)
2020-07-08 01:40:43
【 大 中 小】
|
1、选择题 利用反应:2Ag(aq)+Fe(s)=Fe2+(aq)+2Ag(s)设计原电池并用它作电源进行电解的装置如图所示.NaCl溶液的体积为200mL,假设反应产生的气体全部放出,且反应前后溶液体积的变化忽略不计.下列有关叙述错误的是( )
A.电极A应该用Fe作材料,B是AgNO3溶液,电极C周围溶液变红
B.A、C两极都发生氧化反应,C电极反应式为:2H++2e-=H2↑
C.银电极变粗,为电源的正极,A电极反应式为:Fe-2e-=Fe2+
D.当析出Ag21.6g时,NaCl溶液的pH是反应前的2倍
| 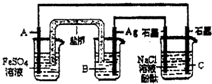
参考答案:A、正极是Ag作材料,则电极A用铁作负极,电解质溶液为AgNO3溶液,电解NaCl溶液时,C是电解池的阴极,发生的反应为2H++2e-═H2↑,或为2H2O+2e-═H2↑+2OH-,
加入酚酞变红,故A正确;
B、A极是原电池的负极,发生氧化反应,C极是电解池的阴极,发生还原反应,故B错误;
C、原电池中,A极是原电池的负极,发生的反应为:Fe-2e-=Fe2+,正极是Ag作材料,电解质溶液为AgNO3溶液,发生的反应为:Ag++e-=Ag,故C正确;
D、当析出Ag21.6g时,n(Ag)═21.6g108g/mol═0.2mol,转移电子0.2mol,根据2H2O+2e-═H2↑+2OH-,可以判断出生成n(OH-)═0.2mol,则c(OH-)═0.2mol0.2L═1mol/L,
故溶液的PH═14,是反应前的2倍.故D正确.
故选B.
本题解析:
本题难度:简单
2、填空题 铝与镁在不同的电解质溶液中分别组成原电池A,B。
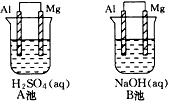
(1)指出各池中的负极材料并写出其电极反应式_________________________。
(2)从构成原电池的几个组成部分来看,判断原电池负极,除了要考虑金属的活动性外,还要考虑
____________________。
参考答案:(1)A池:(+)2H++2e-=H2↑、(-)Mg-2e-=Mg2+、Mg为负极;B池:(+)2H2O+2e-=H2↑+2OH-、(-)Al-3e-+4OH-
=AlO2-+2H2O、Al为负极
(2)电解质溶液的性质,较易与电解质溶液反应的金属材料做原电池的负极
本题解析:
本题难度:一般
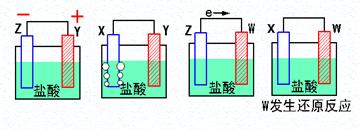
3、填空题 (9分)(1)X、Y、Z、W四种金属片进入稀盐酸中,用导线连接,可以组成原电池,实验结果如下图所示,则四种金属的活泼性由强到弱的顺序为______ _____
(2)假设第一个装置中两个金属片一个是铝片一个是铜片,电解质溶液是盐酸,请写出两极的电极反应式:正极 、负极
(3)用KOH溶液做电解质溶液的氢氧燃料电池的正极反应式
参考答案:(1) Z〉Y〉X〉W 3分
(2)正极: 6H+ + 6e- =3H2↑ 2分负极: 2Al- 6e- =2Al3+ 2分
(3)正极: O2 + 4 e- + 2H2O = 4OH- 2分
本题解析:考查原电池的应用及电极反应式的书写。
(1)在原电池中较活泼的金属作负极,失去电子,发生氧化反应。电子经导线传递到正极上,所以溶液中的阳离子向正极移动,阴离子向负极移动。正极得到电子,发生还原反应。所以根据第1个可知Z的金属性强于Y的,第2个可知Y的金属性强于X的,第3个可知Z强于W的,第4个可知X强于W的,所以四种金属的活泼性由强到弱的顺序为Z〉Y〉X〉W。
(2)铝比铜活泼,铝是负极,铜是正极,电极反应式分别是2Al- 6e- =2Al3+、6H+ + 6e- =3H2↑。
(3)氢氧燃料电池中氧气在正极通入,所以反应式为O2 + 4 e- + 2H2O = 4OH-。
本题难度:一般
4、选择题 如图是模拟电化学反应装置图。下列说法正确的是(?)

A.开关K置于N处,则铁电极的电极反应式为:Fe-2e-=Fe2+
B.开关K置于N处,可以减缓铁的腐蚀
C.开关K置于M处,则铁电极的电极反应式为:2Cl--2e-=Cl2↑
D.开关K置于M处,电子从碳棒经开关K流向铁棒
参考答案:B
本题解析:开关K置于N处,构成电解池,铁电极为阴极,电极反应为2H2O+2e-=H2↑+2OH-,铁的腐蚀减缓;开关K置于M处,构成原电池,铁电极为负极,电极反应式为:Fe-2e-=Fe2+,电子从铁棒经开关K流向碳棒。
本题难度:简单
5、选择题 下列关于实验现象的描述不正确的是
A.把铜片和铁片紧靠在一起浸入稀硫酸中,铜片表面出现气泡
B.用铜片做阳极,铁片做做阴极,电解氯化铜溶液,铁片表面出现一层铜
C.把铜片插入三氯化铁溶液中,在铜片表面出现一层铁
D.把锌粒放入盛有盐酸的试管中,加入几滴氯化铜溶液,气泡放出速率加快
| 