1、实验题 (10分)某高二化学兴趣小组为了探究铝电极在原电池中的作用,设计并 进行了以下一系
进行了以下一系 列实验,实验结果记录如下:
列实验,实验结果记录如下:

(1)实验①、⑤中Al电极的作用是否相同 (填“是”或“否”);
(2)请在方框内画出实验③的原电池装置图,标出正、负极。

(3)实验②中电流计指针偏向 电极(填“Al”或“Cu”),Cu电极反应式为 ;
(4)实验④中铝为 极(填“正”或“负”),其电极反应式为 。
2、选择题 在下图中的8个装置中,属于原电池的是( )
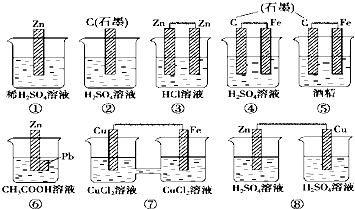
A.①④⑤
B.③⑥⑧
C.④⑥⑦
D.⑥⑦⑧
3、填空题 分碳和氮的许多化合物在工农业生产和生活中有重要的作用。
(1)工业上生产硝酸所需要的一氧化氮常用氨气来制备,该反应的化学方程式为 。
(2)以CO2与NH3为原料可合成化肥尿素[化学式为CO(NH2)2]。已知:
①2NH3(g)+CO2(g)=NH2CO2 NH4(s) △H="-l59.5" kJ·mol-1
②NH2CO2NH4(s)=CO(NH2)2(s)+H2O(g) △H="+116.5" kJ·mol-1
③H2O(1)=H2O(g) △H=+44.0kJ·mol-1
写出CO2与NH3合成尿素和液态水的热化学反应方程式
(3)以氨气代替氢气研发氨燃料电池是当前科研的一个热点,已知氨燃料电池使用的电解质溶液是2mol·L-1的KOH溶液,电池反应为:4NH3+3O2=2N2+6H2O。该电池负极的电极反应式为 ;每消耗3.4g NH3转移的电子数为 (阿伏加德罗常数的值用NA表示)。
(4)用活性炭还原法可以处理氮氧化物。某研究小组向某密闭容器加入一定量的活性炭和NO,发生反应C(s)+2NO(g) N2(g)+CO2(g) △H="Q" kJ·mol-1。
N2(g)+CO2(g) △H="Q" kJ·mol-1。
在T1℃时,反应进行到不同时间测得各物质的浓度如下:
时间(Min)
浓度(mol·L-1)
| 0
| 10
| 20
| 30
| 40
| 50
|
NO
| 1.00
| 0.58
| 0.40
| 0.40
| 0.48
| 0.48
|
N2
| 0
| 0.21
| 0.30
| 0.30
| 0.36
| 0.36
|
CO2
| 0
| 0.21
| 0.30
| 0.30
| 0.36
| 0.36
|
①T1℃时,该反应的平衡常数K= ;
②30min后,只改变某一条件,反应重新达到平衡,根据上表中的数据判断改变的条件可能是 (填字母编号)。
a.加入一定量的活性炭 b.通人一定量的NO
c.适当缩小容器的体积 d.加入合适的催化剂
③若30min后升高温度至T2℃,达到平衡时,容器中NO、N2、CO2的浓度之比为5:3:3,则Q 0(填“>”或“<”)。
4、简答题 某课外活动小组设计了如图所示的装置,调节滑动变阻器,控制电流强度适中的情况下用其进行缓慢电解NaCl溶液及相关实验(此时,打开止水夹a,关闭止水夹b).由于粗心,实验并未达到预期目的,但也看到了令人很高兴的现象(阳离子交换膜只允许阳离子和水通过).
请帮助他们分析并回答下列问题:
(1)写出B装置中的电极反应:
阴极:______;
阳极:______.
(2)观察到A装置中的现象是:
①______;
②______;
③______.
(3)当观察到A装置中的现象后,他们关闭止水夹a,打开止水夹b.再观察C装置,若无现象,请说明理由;若有现象,请写出有关反应的化学方程式(是离子反应的写离子方程式):______.
(4)若想达到电解NaCl溶液的目的,应如何改进装置,请提出你的意见:______.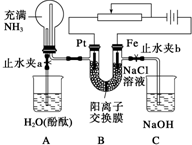
5、选择题 依据氧化还原反应:2Ag+(aq)+Cu(s) = Cu2+(aq)+2Ag(s) 设计的原电池如图所示。下列叙述正确的是?(?)
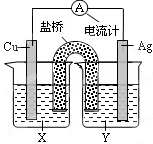
A.Y为CuSO4溶液
B.正极反应为Cu-2e- = Cu2+
C.在外电路中,电流从Cu极流向Ag极
D.将铜片浸入AgNO3溶液中发生的化学反应与该原电池