微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、计算题 在铁和氧化铁的混合物15g中加入150mL稀H2SO4放出氢气1.68L(标准状况)。当反应停止后,铁和氧化铁均无剩余,且溶液中无Fe3+存在。为了中和过量H2SO4,并使Fe2+完全转化为Fe(OH)2沉淀,共耗用3 mol/L NaOH溶液200mL。求:
①混合物中铁和氧化铁各多少克?
②稀H2SO4的物质的量浓度为多少?
2、填空题 (14分)某混合物X由A12O3、Fe2O3、Cu、SiO2中的一种或几种物质组成。进行如下实验。

请回答:
(1)由I可知X中一定存在的是????????????,步骤I所发生反应的离子方程式为:?????????????????????????、???????????????????????????。
(2)反应II的化学方程式是???????????????????????????????。
为进一步确定上述混合物X的成分,另取9.4gX进行如下实验。

(3)由Ⅲ可得出的结论为:??????????????????????????????????????????。
(4)步骤Ⅳ所得蓝色溶液中阳离子为????????????????。
(5)原混合物中各成分的质量之比是????????????????。(不必化简)
3、选择题 硫酸亚铁是一种重要的化工原料,可以制备一系列物质(如下图所示)。下列说法错误的是( )
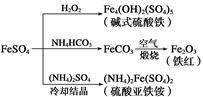
A.碱式硫酸铁水解能产生Fe(OH)3胶体,可用作净水剂
B.为防止NH4HCO3分解,生产FeCO3需在较低温度下进行
C.可用KSCN溶液检验(NH4)2Fe(SO4)2是否被氧化
D.常温下,(NH4)2Fe(SO4)2在水中的溶解度比FeSO4的大
4、填空题 (10分)已知X为Fe2O3和CuO的混合物,且知氧化性顺序:Fe3+>Cu2+>H+>Fe2+。取X样品进行如下图所示的实验:
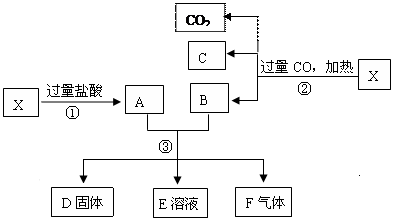
(1)写出③步可能发生反应的离子方程式为 ???????????????????????????。(共有3个)
(2)若溶液E中只有一种金属离子,则一定是??????????????;若溶液E含有两种金属离子,则一定是??????????????。
(3)若D固体是纯净物,该固体是??????????????。(填化学式)
(4)印刷电路板是由高分子材料和铜箔复合而成,可用FeCl3溶液作“腐蚀剂”刻制印刷电路的离子反应方程式为??????????????。
5、简答题 (14分)碱式硫酸铁[Fe(OH)SO4]是一种新型高效絮凝剂,常用于污水处理,在医疗上也可用于治疗消化性溃疡出血。工业上利用废铁屑(含少量氧化铝等)生产碱式硫酸铁的工艺流程如下所示:

部分阳离子以氢氧化物形式沉淀时溶液的pH如表所示:
沉淀物
| Fe(OH)3
| Fe(OH)2
| Al(OH)3
|
开始沉淀
| 2.3
| 7.5
| 3.4
|
完全沉淀
| 3.2
| 9.7
| 4.4
请回答下列问题:
(1)加入少量NaHCO3的目的是调节溶液的pH,除去Al3+,①pH的范围__________,②写出可能发生的离子方程式:________________。
(2)在实际生产中,反应Ⅱ中常同时通入O2,以减少NaNO2的用量,O2与NaNO2在反应中均作__________。若参与反应的O2有11.2 L(标准状况),则相当于节约NaNO2的物质的量为________。
(3)碱式硫酸铁溶于水后产生的Fe(OH)2+可部分水解生成Fe2(OH)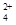 ,该水解反应的离子方程式为________________________________________________________________。 ,该水解反应的离子方程式为________________________________________________________________。
Fe(OH)3的Ksp=____________。(提示,开始沉淀c(Fe3+)浓度为1.0×10-5mol/L)
(4)在医药上常用硫酸亚铁与硫酸、硝酸的混合液反应制备碱式硫酸铁。根据我国质量标准,产品中不得含有Fe2+及NO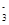 。为检验所得的产品中是否含有Fe2+,应使用的试剂为________。 。为检验所得的产品中是否含有Fe2+,应使用的试剂为________。
|