微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、计算题 在铁和氧化铁的混合物15g中加入150mL稀H2SO4放出氢气1.68L(标准状况)。当反应停止后,铁和氧化铁均无剩余,且溶液中无Fe3+存在。为了中和过量H2SO4,并使Fe2+完全转化为Fe(OH)2沉淀,共耗用3 mol/L NaOH溶液200mL。求:
①混合物中铁和氧化铁各多少克?
②稀H2SO4的物质的量浓度为多少?
参考答案:(1)混合物中铁是7g,氧化铁是8g。(2)稀H2SO4的物
本题解析:(1)设铁和氧化铁的物质的量分别为x和y,则
x×56g/mol+y×160 g/mol=15g……………①
由得失电子守恒得,x×2=y×2+1.68L/22.4L/mol×2……………②
解得:x=0.25mol, y=0.05mol.即m(Fe)=0.25mol×56g/mol=7g, m(Fe2O3)=0.05mo l×160g/mol=8g
(2)在铁和氧化铁的混合物中加入稀H2SO4反应停止后,溶液中的溶质主要是H2SO4和FeSO4。
由电荷守恒知:硫酸中的硫酸
本题难度:简单
2、填空题 (14分)某混合物X由A12O3、Fe2O3、Cu、SiO2中的一种或几种物质组成。进行如下实验。

请回答:
(1)由I可知X中一定存在的是????????????,步骤I所发生反应的离子方程式为:?????????????????????????、???????????????????????????。
(2)反应II的化学方程式是???????????????????????????????。
为进一步确定上述混合物X的成分,另取9.4gX进行如下实验。

(3)由Ⅲ可得出的结论为:??????????????????????????????????????????。
(4)步骤Ⅳ所得蓝色溶液中阳离子为????????????????。
(5)原混合物中各成分的质量之比是????????????????。(不必化简)
参考答案:(1)Fe2O3、Cu???? Fe2O3+6H+===2F
本题解析:(1)和过量的盐酸反应所得溶液显蓝色,说明有铜离子生成。由于单质铜和盐酸是不反应的,所以必须含有氧化铁,氧化铁和盐酸反应生成的铁离子能氧化单质铜,因此X中一定存在的是Fe2O3、Cu,步骤I所发生反应的离子方程式为Fe2O3+6H+===2Fe3++3H2O、? Cu+2Fe3+===2Fe2++Cu2+。
(2)由于剩余的固体和氢氧化钠反应后,仍然有固体剩余,这说明4.92g固体中一定含有二氧化硅,和氢氧化钠溶液的方程式是SiO2+2NaOH===Na2SiO3+H2O。
(3)根据(2)可
本题难度:一般
3、选择题 硫酸亚铁是一种重要的化工原料,可以制备一系列物质(如下图所示)。下列说法错误的是( )
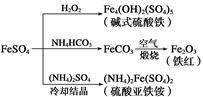
A.碱式硫酸铁水解能产生Fe(OH)3胶体,可用作净水剂
B.为防止NH4HCO3分解,生产FeCO3需在较低温度下进行
C.可用KSCN溶液检验(NH4)2Fe(SO4)2是否被氧化
D.常温下,(NH4)2Fe(SO4)2在水中的溶解度比FeSO4的大
参考答案:D
本题解析:A项,Fe3++3H2O Fe(OH)3(胶体)+3H+;B项,NH4HCO3加热很容易分解,所以制备FeCO3需低温下进行;C项,SCN-可以检验微量Fe3+;D项,FeSO4和(NH4)2SO4冷却时会结晶析出(NH4)2Fe(SO4)2,所以(NH4)2Fe(SO4)2的溶解度较小。
Fe(OH)3(胶体)+3H+;B项,NH4HCO3加热很容易分解,所以制备FeCO3需低温下进行;C项,SCN-可以检验微量Fe3+;D项,FeSO4和(NH4)2SO4冷却时会结晶析出(NH4)2Fe(SO4)2,所以(NH4)2Fe(SO4)2的溶解度较小。
本题难度:一般
4、填空题 (10分)已知X为Fe2O3和CuO的混合物,且知氧化性顺序:Fe3+>Cu2+>H+>Fe2+。取X样品进行如下图所示的实验:
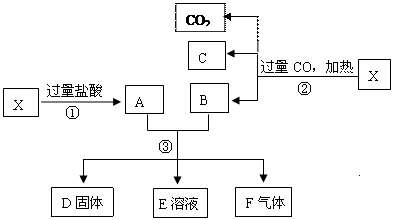
(1)写出③步可能发生反应的离子方程式为 ???????????????????????????。(共有3个)
(2)若溶液E中只有一种金属离子,则一定是??????????????;若溶液E含有两种金属离子,则一定是??????????????。
(3)若D固体是纯净物,该固体是??????????????。(填化学式)
(4)印刷电路板是由高分子材料和铜箔复合而成,可用FeCl3溶液作“腐蚀剂”刻制印刷电路的离子反应方程式为??????????????。
参考答案:(1)2Fe3+ + Fe ="3" Fe2+;Cu2++F
本题解析:略
本题难度:简单
5、简答题 (14分)碱式硫酸铁[Fe(OH)SO4]是一种新型高效絮凝剂,常用于污水处理,在医疗上也可用于治疗消化性溃疡出血。工业上利用废铁屑(含少量氧化铝等)生产碱式硫酸铁的工艺流程如下所示:

部分阳离子以氢氧化物形式沉淀时溶液的pH如表所示: