微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 铁和铁合金是生活中常用的材料,下列说法正确的是
A.一定条件下,铁粉可与水蒸气反应
B.不锈钢是铁合金,只含金属元素
C.铁与盐酸反应,铁合金不与盐酸反应
D.在空气中,铁板比镀锌铁板更耐腐蚀
参考答案:A
本题解析:
试题分析:A、正确;B、不锈钢中含非金属碳,错误;C、不锈钢包括耐弱腐蚀介质腐蚀的钢,它和盐酸能反应,错误;D、在空气中,镀锌铁板比铁板更耐腐蚀,错误。
本题难度:一般
2、选择题 将mg Al2O3、Fe2O3的混和物溶解在过量的100mLpH值为1的硫酸中,然后向其中加入NaOH溶液使Fe3+、Al3+刚好全部转化成沉淀,用去NaOH溶液100mL,则NaOH溶液的浓度为
A.0.1mol/L
B.0.05mol/L
C.0.2mol/L
D.无法计算
参考答案:A
本题解析:
依题意,混合物发生反应前后,反应物和生成物的关系如下:Al2O3+Fe2O3+H2SO4+NaOH Al(OH)3+Fe(OH)3+Na2SO4,易知最终溶液中NaOH全部转化为Na2SO4,根据H2SO4的量可以推算出NaOH的量来。n(H2SO4)=
Al(OH)3+Fe(OH)3+Na2SO4,易知最终溶液中NaOH全部转化为Na2SO4,根据H2SO4的量可以推算出NaOH的量来。n(H2SO4)= 本题难度:一般
本题难度:一般
3、填空题 现有含FeCl2杂质的氯化铜晶体(CuCl2·2H2O),为制取纯净的CuCl2·2H2O,首先将其制成水溶液,然后按下图所示步骤进行提纯:
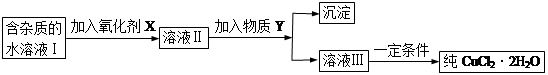

已知H2O2、KMnO4、NaClO、K2Cr2O7均具有强氧化性,要将溶液中的Cu2+、Fe2+、Fe3+沉淀为氢氧化物,需溶液的pH分别为6.4、6.4、3.7。
请回答下列问题 [(1)~(2)小题填标号] :
(1)本实验最适合的氧化剂X是__________
A.K2Cr2O7?????????? B.NaClO??????????? C.H2O2??????????????????D.KMnO4
(2)物质Y不可以是___________
A.CuO?????????????B.CuCl2???????????? C.Cu(OH)2?????????????D.CuCO3
(3)若Y为Cu(OH)2,写出除去Fe3+的离子方程式:????????????????????????????
(4)加入氧化剂的目的是_______________________________________。
(5)最后能不能直接蒸发结晶得到CuCl2·2H2O?__________(填“能”或“不能”)。如不能,应如何操作?(如能,此空不填)_______________________________。
参考答案:(1)C? (2)B? (3) 2Fe3+ +3Cu(OH)
本题解析:
试题分析:(1)四种都是强氧化剂,但其他三种加入后会有杂质出现,无法得到纯CuCl2·2H2O,故选C;(2)所加物质为可与氯化铁发生反应生成沉淀,而B不与氯化铁反应;(3)因为Ksp(Fe(OH)3)<Ksp( Cu(OH)2)所以加入Cu(OH)2后生成Fe(OH)3沉淀。(4)Fe3+性质更为稳定,沉淀物更多;(5)不能;应在氯化氢气氛中浓缩后冷却结晶。
本题难度:一般
4、填空题 (14分).以富含硫酸亚铁的工业废液为原料生产氧化铁的工艺如下(部分操作和条件略):
Ⅰ.从废液中提纯并结晶出FeSO4·7 H2O。
H2O。
Ⅱ.将FeSO4·7H2O配制成溶液。
Ⅲ.FeSO4溶液与稍过量的NH4HCO3溶液混合,得到含FeCO3的浊液。
Ⅳ.将浊液过滤,用90 ℃热水洗涤沉淀,干燥后得到FeCO3固体。
Ⅴ.煅烧FeCO3,得到Fe2O3固体。
已知:NH4HCO3在热水中分解。
(1)Ⅰ中,加足量的铁屑除去废液中的Fe3+,该反应的离子方程式是_________________。
(2)Ⅱ中,需加一定量酸,该酸最好是????。运用化学平衡原理简述该酸的作用________________________________________________________________________。
(3)Ⅲ中,生成FeCO3的离子方程式是___________________________________________
若FeCO3浊液长时间暴露在空气中,会有部分固体表面变为红褐色,该变化的化学方程式是_______________________________________。
(4)Ⅳ中,通过检验SO来判断沉淀是否洗涤干净,检验SO的操作是__________
________________________________________________________________________。
(5)已知煅烧FeCO3的化学方程式是4FeCO3+O22Fe2O3+4CO2。现煅烧464.0  kg的FeCO3,得到316.8 kg产品。若产品中杂质只有FeO,则该产品中Fe2O3的质量是________kg。(摩尔质量/g·mol-1:FeCO3 116 Fe2O3 160 FeO 72)
kg的FeCO3,得到316.8 kg产品。若产品中杂质只有FeO,则该产品中Fe2O3的质量是________kg。(摩尔质量/g·mol-1:FeCO3 116 Fe2O3 160 FeO 72)
参考答案:
 本题解析:略
本题解析:略
本题难度:一般
5、填空题 高铁酸钠的化学式为Na2FeO4,按要求回答下列问题:
(1)高铁酸钠主要通过如下反应制取:
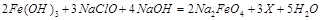 ,则X的化学式为????????。
,则X的化学式为????????。
(2)高铁酸钠是一种新型净水剂,在水中可以发生如下反应:
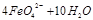

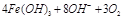 。由此看来,高铁酸钠能够杀菌消毒是因为它具有?????????性,而能够除去水中悬浮物是因为?????????????????????。
。由此看来,高铁酸钠能够杀菌消毒是因为它具有?????????性,而能够除去水中悬浮物是因为?????????????????????。
(3)FeO42-在水溶液中的存在形态如图所示。向pH=8的这种溶液中加KOH溶液,发生反应的离子方程式为????????????????????。
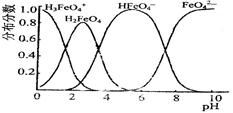
(4)高铁电池是一种新型可充电电池,电解池为碱溶液,其反应式为
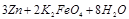 ?
? ?
? 则电池正极材料是???,充电时电池正极?????(填“得”“失”)电子,放电时电池的负极反应式为????????。
则电池正极材料是???,充电时电池正极?????(填“得”“失”)电子,放电时电池的负极反应式为????????。
参考答案:C
本题解析:(1)由质量守恒定律可得X为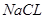 ;
;
(2)高铁酸钠能够杀菌消毒是因为它具有强氧化性,能杀菌、消毒;而能够除去水中悬浮物是因为反应生成氢氧化铁胶体,能够吸附水中的悬浮杂质;
(3)离子方程式为: 本题难度:一般
本题难度:一般