微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 G、Q、X、Y、Z均为氯的含氧化合物,我们不了解它们的化学式,但知道它们在一定条件下具有如下的转换关系(未配平) (1) G→Q + NaCl (2)Q + H2O X + H2 (3) Y + NaOH→G+Q+H2O (4) Z+NaOH→Q+X+H2O这五种化合物中氯的化合价由低到高的顺序是[???? ]
X + H2 (3) Y + NaOH→G+Q+H2O (4) Z+NaOH→Q+X+H2O这五种化合物中氯的化合价由低到高的顺序是[???? ]
A. QGZYX
B. GYQZX
C. GYZQX
D. ZXGYQ
参考答案:B
本题解析:
本题难度:简单
2、选择题 多硫化钠Na2Sx(x>2)在结构上与Na2O2、FeS2、CaC2等有相似之处。Na2Sx在碱性溶液中可被NaClO氧化为Na2SO4,而NaClO被还原为NaCl,反应中Na2Sx与NaClO的物质的量之比为1︰13,则x的值是
A.5
B.4
C.3
D.2
参考答案:B
本题解析:
试题分析:在氧化还原反应中氧化剂得到的电子数与还原剂失去的电子数相等利用电子守恒可得:x(6+2∕x)=13×2,解得x=4
本题难度:一般
3、选择题 有一未完成的离子方程式为: +XO3-+6H+=3X2+3H2O,据此判断,X元素的最高化合价为[???? ]
+XO3-+6H+=3X2+3H2O,据此判断,X元素的最高化合价为[???? ]
A.+7
B.+4
C.+5
D.+1
参考答案:A
本题解析:
本题难度:简单
4、计算题 (8分)工业甲醇的质量分数可以用下列方法测定:
①在稀H2SO4中甲醇被Cr2O72—氧化成CO2和H2O,
反应式为:CH3OH+Cr2O72—+8H+=CO2↑+2Cr3++6H2O;
②过量的Cr2O72—可用Fe2+与之完全反应:
___Cr2O72—+___Fe2++____H+ —_____Cr3++____Fe3++____H2O
现有0.12 g工业甲醇,在H2SO4溶液中与25 mL 0.2 mol·L-1K2Cr2O7溶液反应,多余的K2Cr2O7再用1 mol·L—1FeSO4与其反应,结果用去FeSO4溶液9.6 mL。
(1)配平第②步的离子方程式___________________________
(2)计算工业甲醇的质量分数。
参考答案:(8分)⑴1、6、14、2、6、7 (2分)
本题解析:(1)考查氧化还原反应方程式的配平。根据方程式可知,Cr元素的化合价从+6价降低到+3价,得到3个电子;铁元素的化合价从+2价升高到+3价,失去1个电子,所以根据电子的得失守恒可知,配平后的化学计量数依次是1、6、14、2、6、7。
(2)考查根据方程式进行的有关计算。
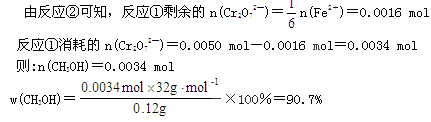 。
。
本题难度:一般
5、选择题 用下列方法制取氧气:
①KMnO4受热分解?②KClO3受热分解(用MnO2作催化剂)?
③2H2O2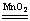 2H2O+O2↑?④2Na2O2+2H2O===4NaOH+O2↑
2H2O+O2↑?④2Na2O2+2H2O===4NaOH+O2↑
若要制得相同质量的氧气,上述四种方法中所转移的电子数目之比是
A.3∶2∶1∶4
B.1∶1∶1∶1
C.1∶2∶1∶2
D.2∶2∶1∶1
参考答案:B
本题解析:反应①②中氧元素都是从-2价升高到0价,转移2个电子,反应③④中氧元素的化合价都是从-1价升高到0价,转移1个电子,所以四种方法中所转移的电子数目之比是2∶2∶1∶1,答案选B。
本题难度:一般