微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 某温度下,将2mo1A和3mo1B充入一密闭容器中,发生反应:aA(g)+B(g)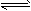 C(g)+D(g),5min 后达到平衡。已知该温度下其平衡常数K=1 ,若温度不变时将容器的体积扩大为原来的10倍,A的转化率不发生变化,则
C(g)+D(g),5min 后达到平衡。已知该温度下其平衡常数K=1 ,若温度不变时将容器的体积扩大为原来的10倍,A的转化率不发生变化,则
[? ]
A.a=1
B.a=2
C.B的转化率为40%
D.B的转化率为20%
参考答案:AC
本题解析:
本题难度:一般
2、选择题 在密闭容器中,反应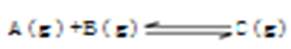 达到平衡后,若增大A的浓度或增大压强使平衡向右移动。下列说法中正确的是
达到平衡后,若增大A的浓度或增大压强使平衡向右移动。下列说法中正确的是
A.C的百分含量一定增大
B.C的浓度一定增大
C.A的百分含量一定增大
D.A的转化率一定增大
参考答案:B
本题解析:增大A的浓度,平衡向右移动,提高B的转化率,本身A的转化率下降,C的产率一定增大,C的浓度逐渐增大,但C的百分含量不一定增大;?
点评:考查化学平衡移动因素,和勒夏特列原理的应用。
本题难度:简单
3、填空题 (13分)难溶性杂卤石(K2SO4·MgSO4·2CaSO4·2H2O)属于“呆矿”,在水中存在如下平衡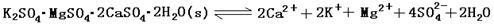
为能充分利用钾资源,用饱和Ca(OH)2溶液溶浸杂卤石制备硫酸钾,工艺流程如下:
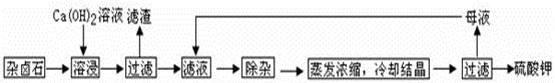
(1)滤渣主要成分有?和?以及未溶杂卤石。
(2)用化学平衡移动原理解释Ca(OH)2溶液能溶解杂卤石浸出K+的原因:?。
(3)“除杂”环节中,先加入?溶液,经搅拌等操作后,过滤,再加入?溶液调滤液PH至中性。
(4)不同温度下,K+的浸出浓度与溶浸时间的关系是图14,由图可得,随着温度升高,?
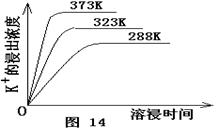
① 在相同时间K+的浸出浓度大。
② 在相同时间K+的浸出浓度减小
③ 反应的速率加快,平衡时溶浸时间短。
④ 反应速率减慢,平衡时溶浸时间增长。
(5)有人以可溶性碳酸盐为溶浸剂,则溶浸过程中会发生:

已知298K时, Ksp(CaCO3)=2.80×10—9, Ksp(CaSO4)=4.90×10—5?,求此温度下该反应的平衡常数K?。
参考答案:(1)CaSO4(1分) Mg(OH)2(1分)
(2)氢氧根与镁离子结合,使平衡向右移动,K+变多。(2分)
(3)K2CO3 (2分)?H2SO4 (2分)
(4)①③(2分)
(5)K=1.75×104(3分)
本题解析:(1)根据题目给出的可逆溶解平衡,加Ca(OH)2后,Mg 2+变成Mg(OH)2,硫酸钙是微溶物,因此滤渣成分是Mg(OH)2,CaSO4和未溶杂卤石;(2)根据勒夏特列原理,加入Ca(OH)2后,Mg 2+不断沉淀,硫酸钙也析出,平衡正移,因此浸出K+;(3)为了使生成的硫酸钾最纯,要除去加入的过量的氢氧化钙,而进入杂质阳离子,因此加入碳酸钾,最后硫酸钾除去过量的碳酸钾且调节溶液pH值;(4)由已知曲线图观察可知,升高温度可以提高K+浸出率,缩短浸出时间;(5)由题意知:Ksp(CaCO3)=2.80×10-9=c(Ca2+)·c(CO32-),Ksp(CaSO4)=4.90×10-5=c(Ca2+)·c(SO42-),因此有:Ksp =1.75×104。
点评:本题在化学工艺流程的背景下对化学反应平衡进行考查,题目难度比较大,综合性较强。
本题难度:一般
4、选择题 工业制备纯硅的反应:SiCl4 (g)+2H2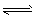 (g)Si(s)+4HCl(g) △H =Q(Q>O),某温度、压强下,将一定量的反应物通入密闭容器进行以上反应,下列叙述正确的是
(g)Si(s)+4HCl(g) △H =Q(Q>O),某温度、压强下,将一定量的反应物通入密闭容器进行以上反应,下列叙述正确的是
[? ]
A.只要时间足够长,SiCl4可完全转化为Si
B.若反应开始时SiCl4为1mol,则达到平衡时,吸收热量为Q
C.反应至4min时,若HCl的浓度为0.12mol·L-1,则H2的反应速率为0.03mol/(L·min)
D.当反应吸收热量为0. 025QkJ时,生成的HCl通入100mL 1mol·L-1的NaOH中恰好反应
参考答案:D
本题解析:
本题难度:一般
5、选择题 下列叙述正确并能用勒沙特列原理解释的是
A.FeCl3+3NH4SCN Fe(SCN)3+3NH4Cl溶液显红色,加少量NH4Cl固体后颜色变浅
Fe(SCN)3+3NH4Cl溶液显红色,加少量NH4Cl固体后颜色变浅
B.红棕色NO2加压后颜色先变深后变浅
C.SO2催化氧化成SO3的反应,往往需要使用催化剂
D.H2、I2、HI平衡混和气加压后颜色变深
参考答案:B
本题解析:加少量NH4Cl固体后颜色变浅,说法错误,应为颜色不变。红棕色NO2加压后颜色先变深后变浅,据2 NO2 N2O4加压平衡向生成N2O4方向移动故加压气体体积变小NO2浓度增大颜色变深继而平衡移动颜色随之变浅正确。催化剂对平衡无影响。H2、I2、HI平衡混和气加压后颜色变深,H2+ I2
N2O4加压平衡向生成N2O4方向移动故加压气体体积变小NO2浓度增大颜色变深继而平衡移动颜色随之变浅正确。催化剂对平衡无影响。H2、I2、HI平衡混和气加压后颜色变深,H2+ I2 2HI知加压对该平衡无影响,但加压气体体积缩小有色I2蒸气浓度增大故颜色变深。
2HI知加压对该平衡无影响,但加压气体体积缩小有色I2蒸气浓度增大故颜色变深。
本题难度:一般