微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 在密闭容器中有反应:aX(g)+bY(g) nW(g);ΔH=Q,某同学根据此反应在不同条件下的实验数据,作出如下曲线:
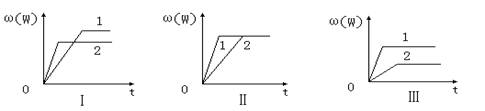
其中,ω(W)表示W在反应混合物中的百分含量,t表示反应时间。其它条件不变时,下列分析可能正确的是?
A.图Ⅰ可能是不同压强对反应的影响,且P2>P1,a+b>n
B.图Ⅱ可能是同温同压催化剂对反应的影响,且1的催化剂效果更好
C.图Ⅱ可能是不同压强对反应的影响,且P1>P2,n<a+b
D.图Ⅲ可能是不同温度对反应的影响,且T1>T2,Q<0
参考答案:B
本题解析:略
本题难度:简单
2、选择题 某温度下,在一个2L的密闭容器中,加入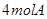 和
和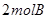 进行如下反应:
进行如下反应:
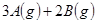

 ,反应一段时间后达到平衡,测得生成
,反应一段时间后达到平衡,测得生成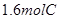 ,则下列说法正确的是
,则下列说法正确的是
A.该反应的化学平衡常数表达式是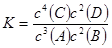
B.此时,B的平衡转化率是40%
C.增大该体系的压强,化学平衡常数增大
D.增加B,B的平衡转化率增大
参考答案:B
本题解析:物质C是固体,不能出现在平衡常数的表达式中,A不正确。生成1.6mol的C,则消耗B是0.8mol,所以转化率是0.8÷2×100%=40%,选项B正确。平衡常数只与温度有关系,C不正确。增加B的量,平衡向正反应方向移动,提高A的转化率,但降低B的转化率,D不正确,答案选B。
本题难度:一般
3、实验题 “酒是陈的香”,就是因为酒在储存过程中生成了有香味乙酸乙酯,在实验室我们也可以用下图所示的装置制取乙酸乙酯。回答下列问题:

(1)写出制取乙酸乙酯的化学反应方程式?。
(2)饱和碳酸钠溶液的主要作用是中①?②?;③?
(3)装置中通蒸气的导管要插在饱和碳酸钠溶液的液面上,不能插入溶液,?
目的是防止 ? 。
(4)若要把制得的乙酸乙酯分离出来,应采用的实验操作是 ?。
(5)生成乙酸乙酯的反应是可逆反应,反应物不能完全变成生成物,反应一段时间后,就达到了该反应的限度,也即达到化学平衡状态。下列描述能说明乙醇与乙酸的酯化反应未达到化学平衡状态的有(填序号) 。
①单位时间里,生成1mol乙酸乙酯,同时生成1mol水
②单位时间里,生成1mol乙酸乙酯,同时生成1mol乙酸
③单位时间里,消耗1mol乙醇,同时消耗1mol乙酸
④正反应的速率与逆反应的速率相等
⑤混合物中各物质的浓度不再变化
参考答案:(1)
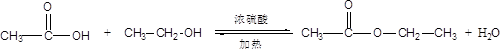
(2) ①?减少乙酸乙酯的溶解度?②?除去乙酸? ;③?除去乙醇?
(3) 倒吸?
(4)分液
(5) ①③
本题解析:(1)酯化反应的本质为酸脱羟基,醇脱氢,乙酸与乙醇在浓硫酸作用下加热发生酯化反应生成乙酸乙酯和水,该反应为可逆反应,其反应方程式为 ;(2)饱和碳酸钠溶液的主要作用是减少乙酸乙酯的溶解度 、除去乙酸 、 除去乙醇;(3)装置中通蒸气的导管要插在饱和碳酸钠溶液的液面上,因为蒸汽含有乙醇乙酸,所以不能插入溶液,目的是防止倒吸;(4)乙酸乙酯不溶于饱和碳酸钠溶液,所以可以用分液的方法将其分离;(5)根据
;(2)饱和碳酸钠溶液的主要作用是减少乙酸乙酯的溶解度 、除去乙酸 、 除去乙醇;(3)装置中通蒸气的导管要插在饱和碳酸钠溶液的液面上,因为蒸汽含有乙醇乙酸,所以不能插入溶液,目的是防止倒吸;(4)乙酸乙酯不溶于饱和碳酸钠溶液,所以可以用分液的方法将其分离;(5)根据 可以知道,单位时间里,生成1mol乙酸乙酯,同时生成1mol水或者是单位时间里消耗1mol乙醇,同时消耗1mol乙酸,不能说明反应已经达到平衡,其他都可以说明反应达到平衡,故本题的答案选择①③。
可以知道,单位时间里,生成1mol乙酸乙酯,同时生成1mol水或者是单位时间里消耗1mol乙醇,同时消耗1mol乙酸,不能说明反应已经达到平衡,其他都可以说明反应达到平衡,故本题的答案选择①③。
点评:该题考查了酯化反应,乙酸乙醇的酯化反应是中心的经典反应,是高考考查的重点,本题属于对基础知识的考查,难度不大。
本题难 度:一般
4、填空题 (5分)在密闭容器中进行的反应C(s)+ H2O(g)  ?CO(g) + H2(g)
?CO(g) + H2(g) 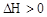 ,改变下列条件:(1)若升高温度,正反应速率?,逆反应速率?(填增大或减小或不变),平衡?移动。
,改变下列条件:(1)若升高温度,正反应速率?,逆反应速率?(填增大或减小或不变),平衡?移动。
(2)若增大CO的浓度,平衡?移动,H2O(g)的转化率?(填增大或减小或不变)。
参考答案:(5分)(1)增大,增大?,正反应方向移动(向左移动)。
(2)逆反应方向移动(向右移动),减小。
本题解析:略
本题难度:一般
5、选择题 在某温度下,将2molA和3molB充入一密闭容器中,发生反应:aA(g)+B(g)  C(g)+D(g),5min后达平衡,各物质的平衡浓度的关系为[c(A)]a·c(B)= c(C)·c(D)。若在温度不变的情况下将容器的体积扩大为原来的10倍,A的转化率不发生变化,则B的转化率为
C(g)+D(g),5min后达平衡,各物质的平衡浓度的关系为[c(A)]a·c(B)= c(C)·c(D)。若在温度不变的情况下将容器的体积扩大为原来的10倍,A的转化率不发生变化,则B的转化率为
A.60%? B.40%? C.24%? D.4%
参考答案:B
本题解析:各物质的平衡浓度的关系为[c(A)]a·c(B)= c(C)·c(D),这说明平衡常数是1。在温度不变的情况下将容器的体积扩大为原来的10倍,A的转化率不发生变化,说明反应前后体积是不变的,即a=1。设B的转化率是x,则消耗B是3x,消耗A是3x,生成CD都是3x,所以根据平衡常数表达式可知 ,解得x=0.4,所以答案选B。
,解得x=0.4,所以答案选B。
本题难度:一般