| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高中化学必备知识点《化学反应速率》高频考点预测(2017年最新版)(三)
③若反应初始时,在容器中加入1.5 mol SO2和0.8 mol O2,则平衡后二氧化硫的转化率?氧气的转化率(填大于、小于或等于)。 (3)烟气中的SO2可以用NaOH溶液吸收,将所得的Na2SO3溶液进行电解,可循环再生NaOH,同时得到H2SO4,其原理如下图所示。(电极材料为石墨) 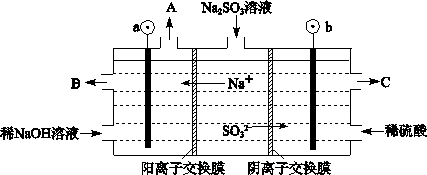 ①图中a极要连接电源的(填“正”或“负”)_______极,C口流出的物质是_______。 ②SO32-放电的电极反应式为_____________________________________。 ③电解过程中若消耗12.6gNa2SO3,则阴极区变化的质量为_______g(假设该过程中所有液体进出口密闭)。 3、选择题 下列措施对增大反应速率有效的是( )
4、选择题 在Zn+H2SO4 = ZnSO4+H2反应中,2分钟内硫酸浓度由l.5 mol·L-1降至1.1 mol·L-1,则2分钟内用硫酸表示的平均反应速率为 ( ) |
5、选择题 一定条件下,在体积固定的密闭容器中,一氧化碳与氢气生成甲醇的反应如下:?
CO(g) +2H2(g)?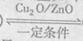 ?CH3OH (g)
?CH3OH (g)
下列说法正确的是?(?)
A.在其他条件不变的情况下,对处于E点的体系
体积压缩到原来的一半,氢气的浓度减少
B.催化剂的存在使一氧化碳与氢气更大限度的
转化生成甲醇
C.用CO表示的反应速率v(CO)D <v(CO)C
D.反应达到平衡时,平衡常数表达式为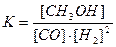
|
||
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | ||
| 下一篇:高中化学知识点总结《蛋白质的组.. | ||