| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高中化学必备知识点《化学反应速率》高频考点预测(2017年最新版)(四)
③若反应初始时,在容器中加入1.5 mol SO2和0.8 mol O2,则平衡后二氧化硫的转化率?氧气的转化率(填大于、小于或等于)。 (3)烟气中的SO2可以用NaOH溶液吸收,将所得的Na2SO3溶液进行电解,可循环再生NaOH,同时得到H2SO4,其原理如下图所示。(电极材料为石墨) 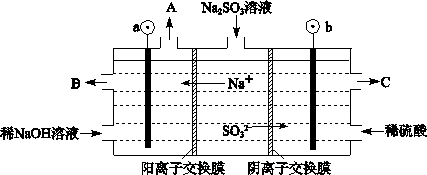 ①图中a极要连接电源的(填“正”或“负”)_______极,C口流出的物质是_______。 ②SO32-放电的电极反应式为_____________________________________。 ③电解过程中若消耗12.6gNa2SO3,则阴极区变化的质量为_______g(假设该过程中所有液体进出口密闭)。 参考答案:(1)2SO2+2H2O+O2=2H2SO4 ?(2)①0.05mol/(L·min)?② BDE ③大于 本题解析:(1)大气中的SO2在烟尘的催化下形成硫酸的反应方程式是2SO2+2H2O+O2=2H2SO4 ;(2)①在反应开始时n(SO2) =2mol,5 min后反应达到平衡,二氧化硫的转化率为50%,则反应消耗的SO2的物质的量为1mol,因为在反应时SO2与 O2是按照2:1消耗的,所以反应的氧气的物质的量为0.5mol,因此υ(O2)=0.5mol÷2L÷5 min=0.05mol/(L·min);②A.在反应中SO2、O2、SO3是按照2:1:2的关系变化的,但是达到平衡时它们的关系可能符合上述比例,也可能不符合。因此不能作为平衡的标志。错误。B.由于该反应的反应前后气体体积不等,若达到平衡,则各种气体的物质的量不变,压强也不变。因此容器内气体的压强不变可以作为判断平衡的标志。正确。C.由于容器的容积不变,反应又符合质量守恒定律,所以无论反应进行到什么程度,容器内混合气体的密度都保持不变,故不可作为判断平衡的标志。错误。D.若反应达到平衡,任何一种物质的物质的量都不变,浓度也不变,因此SO3的物质的量不再变化可以作为判断平衡的标志。正确。E.每产生1个SO2就会同时消耗1个SO3。现在的SO2生成速率和SO3的生成速率相等,即SO2生成速率和SO2的生成速率相等,反应达到平衡。因此可作为判断平衡的标志 。正确。③若反应初始时,在容器中加入1.5 mol SO2和0.8 mol O2,n(SO2):n(O2)<2:1,氧气相对来说过量,所以平衡后二氧化硫的转化率大于氧气的转化率。(3)①在图中由于Na+向a极区域移动,根据同种电荷相互排斥,异种电荷相互吸引的原则a要连接电源的负极,b连接电源的正极,在阳极上SO32-不断放电变为SO42-,因此从C口流出的物质是硫酸。②SO32-放电的电极反应式为SO32-–2e-+H2O=SO42-+2H+。③电解过程中若消耗12.6gNa2SO3,n(Na2SO3)= 12.6g÷126g/mol=0.1mol,则电子转移0.2mol,在阴极发生反应:2H++2e-=H2↑.放出氢气0.1mol,质量减轻0.2g,同时移向该区域0.2mold Na+,是溶液增重4.6g,故该区域的质量总增重4.4g。 本题难度:一般 3、选择题 下列措施对增大反应速率有效的是( )
参考答案:A、浓硫酸具有强氧化性,与铁发生钝化反应,没有氢气生成,不能提高生成气体的反应速率,故A错误; 本题解析: 本题难度:一般 4、选择题 在Zn+H2SO4 = ZnSO4+H2反应中,2分钟内硫酸浓度由l.5 mol·L-1降至1.1 mol·L-1,则2分钟内用硫酸表示的平均反应速率为 ( ) |
参考答案:B
本题解析:v(H2SO4)=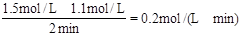 。答案选B。
。答案选B。
考点:化学反应速率的计算
点评:本题非常基础简单,只要根据公式计算即可。
本题难度:一般
5、选择题 一定条件下,在体积固定的密闭容器中,一氧化碳与氢气生成甲醇的反应如下:?
CO(g) +2H2(g)?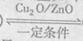 ?CH3OH (g)
?CH3OH (g)
下列说法正确的是?(?)
A.在其他条件不变的情况下,对处于E点的体系
体积压缩到原来的一半,氢气的浓度减少
B.催化剂的存在使一氧化碳与氢气更大限度的
转化生成甲醇
C.用CO表示的反应速率v(CO)D <v(CO)C
D.反应达到平衡时,平衡常数表达式为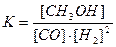
参考答案:D
本题解析:略
本题难度:一般
|
||
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | ||
| 下一篇:高中化学知识点总结《蛋白质的组.. | ||