|
高考化学必考知识点《未知》试题特训(2017年最新版)(四)
2017-03-03 01:04:07
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (14分)铜是与人类关系非常密切的有色金属。已知:常温下,在溶液中Cu2+稳定,Cu+易在酸性条件下发生反应:2Cu+ =Cu2++Cu。大多数+1价铜的化合物是难溶物,如:Cu2O、CuI、CuCl、CuH等。
(1)在新制Cu(OH)2悬浊液中滴入葡萄糖溶液,加热生成不溶物的颜色为: ,某同学实验时却有黑色物质出现,这种黑色物质的化学式为: 。
(2)在CuCl2溶液中逐滴加入过量KI溶液可能发生:
a.2Cu2++4I- =2CuI↓(白色)+I2
b.2Cu2++2Cl-+2I- =2CuCl↓(白色)+I2。
为顺利观察到白色沉淀可以加入的最佳试剂是 。
A.SO2
B.苯
C.NaOH溶液
D.乙醇
| (3)一定条件下,在CuSO4中加入NH5反应生成氢化亚铜(CuH)。
①已知NH5是离子晶体且所有原子都达到稀有气体的稳定结构,请写出NH5的电子式: 。
②写出CuH在过量稀盐酸中有气体生成的离子方程式 。
③将CuH溶解在适量的稀硝酸中, 完成下列化学方程式

(4)常温下,向0.20 mol ? L-1硫酸铜溶液中加入氢氧化钠溶液,生成浅蓝色氢氧化铜沉淀,当溶液的pH = 6时,c(Cu2+)=________________mol.L?1。
[已知:  ] ]
参考答案:(14分)(每空2分)(1)砖红色,CuO (2) B (3) ①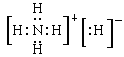
②2CuH + 2H+ ="=Cu" +Cu2+ + 2H2↑ ③6、16、6、3、4NO、8H2O 2.2×10-4
本题解析:(1)在新制Cu(OH)2悬浊液中滴入葡萄糖溶液,加热发生氧化还原反应生成氧化亚铜、葡萄糖酸和水,因此生成不溶物的颜色为砖红色。氧化亚铜不稳定容易转化为黑色的氧化铜,因此这种黑色物质的化学式为CuO。
(2)为顺利观察到白色沉淀,则需要把碘萃取出来,所以可以加入的最佳试剂苯,答案选B。
(3)①已知NH5是离子晶体且所有原子都达到稀有气体的稳定结构,这说明该离子化合物是由H-和铵根两种构成的,所以NH5的电子式为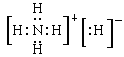 。 。
②Cu+易在酸性条件下发生反应2Cu+=Cu2++Cu,则CuH在过量稀盐酸中有气体生成的离子方程式为2CuH + 2H+ ="=Cu" +Cu2+ + 2H2↑。
③硝酸具有强氧化性,因此铜转化为硝酸铜,还原产物是NO,另外还有水和氢气生成,1molCuH失去2个电子,硝酸作氧化剂得到3个电子,则根据电子得失守恒和原子守恒可知配平后的方程式为6CuH+16HNO3=6Cu(NO3)2+3H2↑+4NO↑+8H2O.
(4)溶液pH=6,则氢氧根离子的浓度水10—8mol/L,所以根据氢氧化铜的溶度积常数可知溶液中铜离子浓度是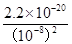 =2.2×10-4mol/L。 =2.2×10-4mol/L。
考点:考查醛基的性质、电子式、氧化还原反应以及溶度积常数应用等
本题难度:困难
2、填空题 Ⅰ.磷、硫元素的单质和化合物应用广泛。
(1)磷元素的原子结构示意图是?。?
(2)磷酸钙与焦炭、石英砂混合,在电炉中加热到1 500 ℃生成白磷,反应为:
2Ca3(PO4)2+6SiO2 6CaSiO3+P4O10 6CaSiO3+P4O10
10C+P4O10 P4+10CO P4+10CO
每生成1 mol P4时,就有??mol电子发生转移。?
(3)硫代硫酸钠(Na2S2O3)是常用的还原剂。在维生素C(化学式C6H8O6)的水溶液中加入过量I2溶液,使维生素C完全氧化,剩余的I2用Na2S2O3溶液滴定,可测定溶液中维生素C的含量。发生的反应为:
C6H8O6+I2 C6H6O6+2H++2I- C6H6O6+2H++2I-
2S2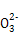 +I2 +I2 S4 S4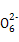 +2I- +2I-
在一定体积的某维生素C溶液中加入a mol/L I2溶液V1 mL,充分反应后,用Na2S2O3溶液滴定剩余的I2,消耗b mol/L Na2S2O3溶液V2 mL。该溶液中维生素C的物质的量是?mol。
(4)在酸性溶液中,碘酸钾(KIO3)和亚硫酸钠可发生如下反应:
2I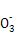 +5S +5S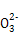 +2H+ +2H+ I2+5S I2+5S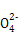 +H2O +H2O
生成的碘可以用淀粉溶液检验,根据反应溶液出现蓝色所需的时间来衡量该反应的速率。
某同学设计实验如下表所示:
?
| 0.01 mol/LKIO3酸性溶液(含淀粉)的体积/mL
| 0.01 mol/LNa2SO3溶液的体积/mL
| H2O的体积/mL
| 实验温度/℃
| 溶液出现蓝色时所需时间/s
| 实验1
| 5
| V1
| 35
| 25
| ?
| 实验2
| 5
| 5
| 40
| 25
| ?
| 实验3
| 5
| 5
| V2
| 0
| ?
|
?
该实验的目的是?;表中V2=??mL。
Ⅱ.稀土元素是宝贵的战略资源,我国的蕴藏量居世界首位。
(5)铈(Ce)是地壳中含量最高的稀土元素。在加热条件下CeCl3易发生水解,无水CeCl3可用加热CeCl3·6H2O和NH4Cl固体混合物的方法来制备。其中,NH4Cl的作用是?。
(6)在某强酸性混合稀土溶液中加入H2O2,调节pH≈3,Ce3+通过下列反应形成Ce(OH)4沉淀得以分离。完成反应的离子方程式:
Ce3++H2O2+H2O Ce(OH)4↓+?。 Ce(OH)4↓+?。
参考答案:(1)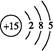
(2)20
(3)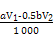 (或其他合理答案) (或其他合理答案)
(4)探究该反应的速率与温度、亚硫酸钠溶液浓度的关系(或其他合理答案) 40
(5)分解出氯化氢气体,抑制CeCl3水解(或其他合理答案)
(6)2Ce3++1H2O2+6H2O 2Ce(OH)4↓+6H+ 2Ce(OH)4↓+6H+
本题解析:Ⅰ.(1)P的原子序数是15,因此其原子结构示意图为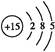 。 。
(2)P元素的化合价由+5价降到了P4中的0价,故每生成1 mol P4转移20 mol电子。
(3)根据化学方程式可知,I2的物质的量等于硫代硫酸钠的物质的量的一半加上维生素C的物质的量,则维生素C的物质的量为:(V1·a×10-3-0.5V2·b×10-3)mol。
(4)通过分析表中的数据可知,该实验研究的是温度、浓度对反应速率的影响;由于实验1和实验2的温度相同,故实验2与实验3的溶液的浓度一定相同,即水的体积一定相同,因此V2=40(mL)。
Ⅱ.(5)由于加热时氯化铵分解放出氯化氢气体,可以抑制CeCl3的
水解。
(6)分析反应可知,Ce3+化合价升高到了Ce(OH)4中的+4价,而H2O2中O的化合价由-1价降到-2价,根据电子守恒可确定Ce3+的化学计量数是2,而H2O2的化学计量数为1,再根据电荷守恒可知缺少的物质是H+,最后根据原子守恒配平反应:2Ce3++1H2O2+6H2O 2Ce(OH)4↓+6H+。 2Ce(OH)4↓+6H+。
本题难度:一般
3、选择题 化学反应SO2+H2O+HNO3-H2SO4+NO经配平后,还原剂的化学计量数为( )
A.1
B.2
C.3
D.4
参考答案:SO2+H2O+HNO3-H2SO4+NO,该反应中化合价的变化如下:SO2→H2SO4,S元素由+4价→+6价,一个SO2分子失2个电子,所以SO2是还原剂;HNO3→NO,N元素由+5价→+2价,一个HNO3分子得3个电子,所以硝酸是氧化剂;得失电子的最小公倍数为6,所以SO2的化学计量数为3,HNO3的化学计量数为2,其它元素根据原子守恒配平.所以该方程式为
3SO2+2H2O+2HNO3=3H2SO4+2NO.
故选C.
本题解析:
本题难度:简单
4、选择题 三氟化氮(NF3)是一种新型电子材料,它在潮湿的空气中与水蒸气能发生氧化还原反应,其反应的产物有: HF、 NO 和 HNO3。则下列说法错误的是 (? )
A.反应过程中,被氧化与被还原的元素的物质的量之比为1 :2
B.NF3是一种无色、无臭的气体,因此NF3在潮湿的空气中泄漏时不易被察觉
C.一旦NF3泄漏,可以用NaOH溶液喷淋的方法减少空气污染
D.若反应中生成1.0mol NO,转移的电子数目为6.02×1023
参考答案:B
本题解析:反应的化学方程式为3NF3+5H2O=9HF+2NO+HNO3,反应中被氧化与被还原的元素的物质的量之比为1:2,A正确;B项,虽然NF3无色无味,但是却能与水反应生成NO在空气中会变为红棕色,所以错误;C.一旦NF3泄漏会生成有毒气体HF、 NO 和 HNO3可以用NaOH溶液喷淋的方法减少空气污染,正确;D项转移的电子数目为2×6.02×1023.
本题难度:一般
5、推断题 (16分)以黄铁矿为原料制硫酸产生的硫酸渣中含Fe2O3、SiO2、Al2O3、MgO等,用硫酸渣制备铁红(Fe2O3)的过程如下:

(1)酸溶过程中Fe2O3与稀硫酸反应的化学方程式为 ;
“滤渣A”主要成份的化学式为 。
(2)还原过程中加入FeS2的目的是将溶液中的Fe3 +还原为Fe2 +,而本身被氧化为H2SO4,请完成该反应的离子方程式:FeS2 + 14Fe3 + + H2O="=" 15Fe2 + + SO42- + 。
(3)氧化过程中,O2、NaOH与Fe2+反应的离子方程式为 。
(4)为了确保铁红的质量,氧化过程需要调节溶液的pH的范围是 (几种离子沉淀的pH见下表);滤液B可以回收的物质有(写化学式) 。
沉淀物
| Fe(OH)3
| Al(OH)3
| Fe(OH)2
| Mg(OH)2
| 开始沉淀pH
| 2.7
| 3.8
| 7.6
| 9.4
| 完全沉淀pH
| 3.2
| 5.2
| 9.7
| 12.4
|
参考答案:(16分)
(1)(5分)Fe2O3 + 3H2SO4 ="=" Fe2(SO4) 3+ 3H2O(2分。化学式1分、配平1分)
SiO2(2分。多写FeS2不扣分,多写其它化学式0分)
(2)(3分)8 2 16H+(第空1分)
(3)(4分)4Fe2 + + O2 + 2H2O + 8OH-= 4Fe(OH)3↓ (化学式对2分、配平2分。或
Fe2++2OH-=Fe(OH)2↓(2分),4Fe(OH)2+O2+2H2O=4Fe(OH)3(2分)
(分两个方程写:第个方程式化学式对1分、配平1分)
(4)(5分)3.2~3.8(或之间的数据值,2分) Na2SO4、Al2(SO4)3、MgSO4(3分,多写H2SO4不扣分,多写其它0分)
本题解析:(1)氧化铁与稀硫酸反应生成硫酸铁和水,化学方程式为Fe2O3 + 3H2SO4 ="=" Fe2(SO4) 3+ 3H2O;硫酸渣中只有二氧化硅不与稀硫酸反应,所以“滤渣A”主要成份的化学式为SiO2;
(2)FeS2中的S元素的化合价是-1价,生成物中Fe的化合价是+2价,S的化合价是+6价,整体升高14价,而Fe3+的化合价降低1价,根据升降化合价总数相等,所以Fe3+的系数是14,则SO42-的系数是2,再根据元素守恒和电荷守恒判断生成物中还有氢离子,其系数为16,则水的系数是8;
(3)O2、NaOH与Fe2+反应生成氢氧化铁沉淀,离子方程式为4Fe2 + + O2 + 2H2O + 8OH-= 4Fe(OH)3↓;
(4)根据表中数据使铁离子完全沉淀,而其他离子不能沉淀,所以溶液的pH的范围是)3.2~3.8;滤液B中则含有其他离子的硫酸盐,如Na2SO4、Al2(SO4)3、MgSO4。
考点:考查对工艺流程的分析,物质的判断,化学方程式的配平
本题难度:困难
| 

 ]
]  Ce(OH)4↓+?。
Ce(OH)4↓+?。