微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列各组比较项目包含的数据关系中,前者比后者大的是(?)
A.氯水与氨水中微粒种数
B.H2O2与O2分子中氧氧键键能
C.CH4分子与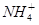 离子中的键角
离子中的键角
D.相同质量的铜片分别和过量浓硝酸、稀硝酸反应转移的电子数
参考答案:A
本题解析:A选项氯水中微粒种类有7种,氨水中微粒种类有6种,正确。B选H2O2中时氧氧单键,而O2是氧氧双键,双键键能大,错误。C选项CH4分子与NH4+都是正四面体,键角一样大,错误。D选项因Cu片的质量相同,转移的电子数相同,错误。
本题难度:一般
2、填空题 (1)配平下列离子反应方程式:______Cu2S+______HNO3--______Cu(NO3)2+______H2SO4+______NO+______H2O
(2)在标准状况下生成2.24LNO时,转移电子物质的量为______.
参考答案:(1)Cu化合价从+1变为+2,S化合价从-2变为+6;N化合价从+5变为+2
则化合价升高=1×2+8=10
化合价降低=5-2=3
化合价升降最小公倍数为30,所以Cu2S的系数为3,NO系数为10,再根据原子守恒观察配平其它物质的系数,所以
3Cu2S+22HNO3═6Cu(NO3)2+3H2SO4+10NO+8H2O
故答案为:3;22;6;3;10;8
(2)转移电子物质的量2.24L22.4L/mol×3=0.3mol.
故答案为:0.3mol
本题解析:
本题难度:一般
3、选择题 铁氧磁体法处理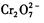 的废水的原理可概述为:向
的废水的原理可概述为:向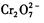 的酸性废水中加人FeSO4·7H2O ,将
的酸性废水中加人FeSO4·7H2O ,将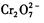 还原为Cr3+,调节溶液的 pH,使溶液中的铁、铬元素转化为组成相当于FeⅡ[FeⅢXCrⅢ 2-X]O4(铁氧磁体、罗马数字表示元素的价态)的沉淀。处理含 1 mol
还原为Cr3+,调节溶液的 pH,使溶液中的铁、铬元素转化为组成相当于FeⅡ[FeⅢXCrⅢ 2-X]O4(铁氧磁体、罗马数字表示元素的价态)的沉淀。处理含 1 mol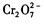 的废水至少需要加人amol FeSO4·7H2O?。下列结论正确的是?(?)
的废水至少需要加人amol FeSO4·7H2O?。下列结论正确的是?(?)
A.x= 0.5 , a=" 8"
B.x = 0.5 , a="10"
C.x = 1.5 , a=" 8"
D.x = 1.5 , a= 10
参考答案:D
本题解析:略
本题难度:一般
4、选择题 (9分)利用氧化还原反应原理配平
⑴? NH3 + ? Cl2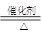 ??N2 + ?NH4Cl
??N2 + ?NH4Cl
⑵ FeSO4 + KNO3 + H2SO4 = K2SO4 + Fe2(SO4)3 + NO↑+ H2O
在(2)的反应中?元素被氧化,?是还原产物,该反应中体现硫酸的?性。当反应中有0.3mol电子发生转移时,生成NO的体积(标准状况)??L。
参考答案:(1)8? 3? 1? 6?(2分)
(2)6? 2 ?4? 3? 2? 4(2分)
Fe? ;? NO ;?酸性;(各1分)? 2.24?(2分)
本题解析:⑴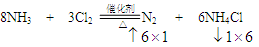
⑵
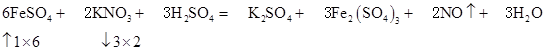 Z转移6mole-
Z转移6mole-
本题难度:一般
5、计算题 已知:化学反应3Ag+ 4HNO3 (稀)= 3AgNO3+ NO↑+ 2H2O?
(1)该反应的离子方程式为:_________________________________? ____
(2)当有32.4克银溶解时,反应生成的NO在标况下的体积是多少?
(3)当有0.2mol银溶解时,有多少克HNO3被还原?
参考答案:(1)3Ag+4H++NO3-=3Ag++NO↑+2H2O
(2)2.24L?(3)4.2g
本题解析:考查根据方程式进行的有关计算。
(1)根据化学方程式可知,该反应的离子方程式为3Ag+4H++NO3-=3Ag++NO↑+2H2O。
(2)32.4g银是324g÷108g.mol=0.3mol,所以根据方程式可知生成NO是0.1mol,标准状况下的体积是2.24L。
(3)0.2mol银失去0.2mol电子。稀释在反应中得到3个电子,所以被还原的硝酸是 。
。
本题难度:一般