微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 在一定条件下,可逆反应A(气)+B(气)?2C(气)?达到平衡的标志是( )
①A、B、C?的分子数比为1:1:2
②A、B、C?的浓度不再发生变化
③单位时间生成n摩尔A,同时增加2n摩尔C
④平衡体系中的压强不再发生变化.
A.①②
B.①④
C.②③
D.②④
参考答案:①、平衡时A、B、C?的分子数比可能为1:1:2,可能不是1:1:2,与反应物的起始物质的量、转化率有关,故①错误;
②、可逆反应达到平衡状态时,各物质的浓度不变,A、B、C?的浓度不再发生变化,说明到达平衡状态,故②正确;
③、单位时间生成nmolA,同时增加2nmolC,生成2nmolC需要消耗nmolA,单位时间内A的生成与消耗的物质的量相等,反应到达平衡,故③正确;
④、反应前后气体的物质的量不变,容器内气体的压强始终不变,故压强不变,不能说明到达平衡状态,故④错误;
故选C.
本题解析:
本题难度:简单
2、选择题 一定条件下,可逆反应2A?B+3C,在四种状态中处于平衡状态的是( )
| 正反应速率 | 逆反应速率
A
υA=2mol/(L?min)
υB=2mol/(L?min)
B
υA=2mol/(L?min)
υC=2mol/(L?min)
C
υA=1mol/(L?min)
υB=2mol/(L?min)
D
υA=1mol/(L?min)
υC=1.5mol/(L?min)
|
A.A
B.B
C.C
D.D
参考答案:化学反应到达平衡时,同一物质的正逆反应速率相等.
A、A物质的正反应速率υA=2mol/(l.min),逆反应速率υB=2mol/(l.min),则逆反应速率υA=4mol/(l.min),A的正逆反应速率不相等,所以该反应未达到平衡状态,故A错误.
B、同一反应中,各物质的反应速率之比等于计量数之比,A物质的正反应速率是2mol/(L.min),C的逆反应速率为2mol/(L.min),A的逆反应速率为34mol/(L.min),所以A的正逆反应速率不等,故B错误.
C、同一反应中,各物质的反应速率之比等于计量数之比,A物质的正反应速率是1 mol/(L.min),B的逆反应速率为2mol/(L.min),A的逆反应速率为4mol/(L.min),所以A的正逆反应速率不等,故C错误.
D、同一反应中,各物质的反应速率之比等于计量数之比,A物质的正反应速率是1 mol/(L.min),C的逆反应速率为1.5mol/(L.min),A的逆反应速率为1mol/(L.min),所以A的正逆反应速率相等,故D正确.
故选D.
本题解析:
本题难度:简单
3、填空题 碘及其化合物在人类活动中占有重要地位。
(1)加碘食盐中含有碘酸钾(KIO3),工业上以电解法制备碘酸钾,电解设备如图所示。先将一定量的碘溶于过量氢氧化钾溶液,发生反应:

3I2+6KOH=5KI+KIO3+3H2O,再将该溶液加入?(阴极、阳极)区,另将氢氧化钾溶液加入另外一个区。使用?(阴、阳)离子交换膜,在阳极发生的电极反应式:?。
(2)碘化氢不稳定,分解反应的热化学方程式是2HI(g)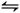 I2(g)+H2(g) ?ΔH="+9.48" kJ·mol-1已知ΔS>0
I2(g)+H2(g) ?ΔH="+9.48" kJ·mol-1已知ΔS>0
①该反应属于(? )
A.任何温度均自发? B.任何温度均不自发? C.高温自发? D.低温自发
②一定条件下,反应在一个带有活塞的密闭容器中达到平衡,下列说法中不正确的是(? )
A.恒温,缩小体积,平衡常数不变
B.恒温,缩小体积,平衡不移动,颜色加深
C.恒容,升温,正向反应速率和逆向反应速率均增大?
D.恒容,在容器中若投入2mol HI,达到平衡时吸收9.48 kJ 的热量?
③一定温度下,平衡常数K=1/4,在2L的容器中,加入4molHI发生反应达到平衡,HI的转化率?。
参考答案:(1)阳极?阴?I-+6OH-—6e-=IO3-+3H2O?(2)①C②D?③0.5
本题解析:(1)由题意知电解法制备碘酸钾的原理为在KOH存在的条件电解KI和KIO3的混合液,反应的实质是碘离子发生失电子的氧化反应,最终生成碘酸根离子,结合电解原理电解池的阳极发生失电子的氧化反应,所以KI和KIO3的混合液应加在与电源正极相连的阳极区,即装置中的a极区;根据电极方程式书写原则原子守恒和电荷守恒,电极反应式为:I-+6OH-—6e-=IO3-+3H2O,该极区反应消耗OH—,应有加在阴极区的KOH溶液补充,离子交换膜应允许阴离子通过,为阴离子交换膜。
(2)①该反应ΔH>0,ΔS>0,根据反应方向的判据可知高温时ΔH—TΔS<0,能自发进行;选C.
②A、平衡常数的影响因素为温度,正确;B、该反应两边气体物质系数相等,恒温,缩小体积,平衡不移动,但各物质的浓度增大,颜色加深,正确;C、升温反应速率加快,正确;D、可逆反应的特点是不能进行到底,投入2mol HI,达到平衡时吸收的热量小于9.48 kJ,错误。
③?设转化的碘化氢为x,利用三段法得出各物质的平衡浓度,代入平衡常数表达式求出碘化氢的平衡浓度,代入转化率计算公式计算可得。
本题难度:困难
4、选择题 某温度下,密闭容器中X、Y、Z、W四种气体的初始浓度和平衡浓度如下表,下列说法错误的是
物质
| X
| Y
| Z
| W
|
初始浓度/mol·L-1
| 0.5
| 0.6
| 0
| 0
|
平衡浓度/mol·L-1
| 0.1
| 0.1
| 0.4
| 0.6
|
?
A.反应达到平衡时,X的转化率为80%?
B.该反应的平衡常数表达式为K=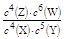
C.增大压强其平衡常数不变,但使平衡向生成Z的方向移动
D.改变温度可以改变此反应的平衡常数
参考答案:C
本题解析:根椐化学计量数的比为反应速率之比,可知,该题中反应物是X和Y,生成物是Z和W,可知化学计量数为:4、5、4、6,也是说反应方程式为:4X+5Y 4Z+6W。可知,当增大压强时,平衡向逆向移动,使得Z的含量减少。因此C错误。
4Z+6W。可知,当增大压强时,平衡向逆向移动,使得Z的含量减少。因此C错误。
本题难度:一般
5、选择题 恒温恒容下,反应A(g)+3B(g)?2C(g)容器中达到平衡的标志是( )
A.C生成的速率与B生成的速率相等
B.单位时间内生成nmolA,同时生成3nmolB
C.容器内总压强不随时间而改变
D.A、B、C分子数之比为1:3:2
参考答案:A、C的生成速率与B的生成速率之比为2:3时,反应达到平衡状态,故A错误.
B、无论该反应是否达到平衡状态,单位时间内生成nmolA,同时生成3nmolB,故B错误.
C、该反应是一个反应前后气体体积有变化的反应,当反应达到平衡状态时,混合物中各组成成分的浓度、百分含量不变,容器内总压强不随时间而改变,故C正确.
D、反应达到平衡时,A、B、C的分子数之比可能为1:3:2,也可能不是1:3:2,这与该反应的初始分子数及转化率有关,故D错误.
故选C.
本题解析:
本题难度:简单