微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 在BaSO4饱和溶液中加入少量BaCl2溶液时产生沉淀,若以Ksp表示BaSO4的溶度积常数,则平衡后溶液中( )
A.c(Ba2+)=c(SO )=(Ksp)
)=(Ksp)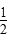
B.c(Ba2+)·c(SO )=Ksp,c(Ba2+)>c(SO
)=Ksp,c(Ba2+)>c(SO )
)
C.c(Ba2+)·c(SO )>Ksp,c(Ba2+)=c(SO
)>Ksp,c(Ba2+)=c(SO )
)
D.c(Ba2+)·c(SO )≠Ksp,c(Ba2+)<c(SO
)≠Ksp,c(Ba2+)<c(SO )
)
2、选择题 已知298K时,Ksp(CaCO3)= 2.80×10-9,Ksp(CaSO4)= 4.90×10-5。若用难溶盐在溶液中的物质的量浓度来表示其溶解度,则下面的叙述正确的是(? )
A.298K时,CaSO4的溶解度约为7.00×10-2 mol/L
B.反应CaSO4(s) + CO32-= CaCO3(s) + SO42-在298K时的平衡常数K= Ksp(CaSO4) / Ksp(CaCO3) = 1.75×104
C.CaCO3、CaSO4的饱和溶液的导电能力很弱,所以它们都是弱电解质
D.升高温度,两种盐的溶度积与溶解度都保持不变
3、选择题 下表是五种银盐的溶度积常数(25 ℃),下列有关说法错误的是( )
化学式
| AgCl
| Ag2SO4
| Ag2S
| AgBr
| AgI
|
溶度积
| 1.8×10-10
| 1.4×10-5
| 6.3×10-50
| 7.7×10-13
| 8.5×10-16
|
A.五种物质在常温下溶解度最大的是Ag2SO4
B.将AgCl溶解于水后,向其中加入Na2S,则可以生成黑色的Ag2S沉淀
C.沉淀溶解平衡的建立是有条件的,外界条件改变时,平衡也会发生移动
D.常温下,AgCl、AgBr和AgI三种物质的溶解度逐渐增大
4、简答题 沉淀物并非绝对不溶,且在水及各种不同的溶液中溶解度有所不同,同离子效应、络合物的形成等都会使沉淀物的溶解度有所改变.已知AgCl+Cl-═[AgCl2]-,如图是某温度下AgCl在NaCl溶液中的溶解情况.
由以上信息可知:
(1)由图知该温度下AgCl的溶度积常数为______.
(2)AgCl在NaCl溶液中的溶解出现如图所示情况(先变小后变大)的原因是:______
(3)设计实验证明S(AgCl)>S(AgI)>S(Ag2S),实验方案是______
(4)若在AgCl形成的浊液中滴加氨水有什么现象?______发生反应的离子方程式为______.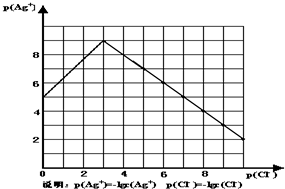
5、选择题 下列实验操作与预期实验目的或所得实验结论一致的是
选项
| 实验操作
| 实验目的或结论
|
A
| 某钾盐溶于盐酸,产生能使澄清石灰水变浑浊的无色无味气体
| 说明该钾盐是K2CO3
|
B
| 向含有少量FeCl3的MgCl2溶液中加入足量Mg(OH)2粉末,搅拌一段时间后过滤
| 除去MgCl2溶液中少量FeCl3
|
C
| 常温下,向饱和Na2CO3溶液中加少量BaSO4粉末,过滤,向洗净的沉淀中加稀盐酸,有气泡产生
| 说明常温下Ksp(BaCO3)<Ksp(BaSO4)
|
D
| C2H5OH与浓硫酸170 ℃共热,制得的气体通入酸性KMnO4溶液
| 检验制得气体是否为乙烯
|