微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 在BaSO4饱和溶液中加入少量BaCl2溶液时产生沉淀,若以Ksp表示BaSO4的溶度积常数,则平衡后溶液中( )
A.c(Ba2+)=c(SO )=(Ksp)
)=(Ksp)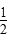
B.c(Ba2+)·c(SO )=Ksp,c(Ba2+)>c(SO
)=Ksp,c(Ba2+)>c(SO )
)
C.c(Ba2+)·c(SO )>Ksp,c(Ba2+)=c(SO
)>Ksp,c(Ba2+)=c(SO )
)
D.c(Ba2+)·c(SO )≠Ksp,c(Ba2+)<c(SO
)≠Ksp,c(Ba2+)<c(SO )
)
参考答案:B
本题解析:BaSO4 Ba2++SO
Ba2++SO ,当加入BaCl2时,溶液中的c(Ba2+)增大,平衡向左移动,但溶度积常数不变,而且c(Ba2+)>c(SO
,当加入BaCl2时,溶液中的c(Ba2+)增大,平衡向左移动,但溶度积常数不变,而且c(Ba2+)>c(SO )。
)。
本题难度:一般
2、选择题 已知298K时,Ksp(CaCO3)= 2.80×10-9,Ksp(CaSO4)= 4.90×10-5。若用难溶盐在溶液中的物质的量浓度来表示其溶解度,则下面的叙述正确的是(? )
A.298K时,CaSO4的溶解度约为7.00×10-2 mol/L
B.反应CaSO4(s) + CO32-= CaCO3(s) + SO42-在298K时的平衡常数K= Ksp(CaSO4) / Ksp(CaCO3) = 1.75×104
C.CaCO3、CaSO4的饱和溶液的导电能力很弱,所以它们都是弱电解质
D.升高温度,两种盐的溶度积与溶解度都保持不变
参考答案:B
本题解析:固体的溶解度是g,A不正确;根据反应的方程式可知,该反应的平衡常数K=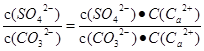 =Ksp(CaSO4) / Ksp(CaCO3) = 1.75×104,B正确;CaCO3、CaSO4都是强电解质,与溶液的导电性强弱无关系,C不正确;升高温度,促进溶解,两种盐的溶度积与溶解度都增大,D不正确,答案选B。
=Ksp(CaSO4) / Ksp(CaCO3) = 1.75×104,B正确;CaCO3、CaSO4都是强电解质,与溶液的导电性强弱无关系,C不正确;升高温度,促进溶解,两种盐的溶度积与溶解度都增大,D不正确,答案选B。
点评:该题是高考中的常见题型,属于中等难度的试题。该题的关键是明确溶解平衡的特点、溶度积常数的含义以及外界条件对溶解平衡和溶度积常数的影响,有利于培养学生的逻辑推理能力,提高学生的应试能力和学习效率,激发学生的学习积极性。
本题难度:一般
3、选择题 下表是五种银盐的溶度积常数(25 ℃),下列有关说法错误的是( )
化学式
| AgCl
| Ag2SO4
| Ag2S
| AgBr
| AgI
|
溶度积
| 1.8×10-10
| 1.4×10-5
| 6.3×10-50
| 7.7×10-13
| 8.5×10-16
|
A.五种物质在常温下溶解度最大的是Ag2SO4
B.将AgCl溶解于水后,向其中加入Na2S,则可以生成黑色的Ag2S沉淀
C.沉淀溶解平衡的建立是有条件的,外界条件改变时,平衡也会发生移动
D.常温下,AgCl、AgBr和AgI三种物质的溶解度逐渐增大
参考答案:D
本题解析:根据Ksp可以看出Ag2SO4的溶解度最大,A对。溶解度大的难溶物容易转变成溶解度小的难溶物,B对。外界条件改变,沉淀溶解平衡移动,C错。所以错误的选项是D。
点评:Ksp不能直接确定溶解度的大小,但是对于同一类型的物质,Ksp越大,溶解度越大。
本题难度:一般
4、简答题 沉淀物并非绝对不溶,且在水及各种不同的溶液中溶解度有所不同,同离子效应、络合物的形成等都会使沉淀物的溶解度有所改变.已知AgCl+Cl-═[AgCl2]-,如图是某温度下AgCl在NaCl溶液中的溶解情况.
由以上信息可知:
(1)由图知该温度下AgCl的溶度积常数为______.
(2)AgCl在NaCl溶液中的溶解出现如图所示情况(先变小后变大)的原因是:______
(3)设计实验证明S(AgCl)>S(AgI)>S(Ag2S),实验方案是______
(4)若在AgCl形成的浊液中滴加氨水有什么现象?______发生反应的离子方程式为______.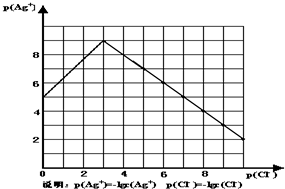
参考答案:(1)AgCl的溶度积常数Ksp=c(Ag+)?c(Cl-)=10-9mol/L?10-3mol/L=10-12,故答案为:10-12;
(2)根据沉淀溶解平衡:AgCl(s)=Cl-(aq)+Ag+(aq),将氯化银放在氯化钠中,Cl-抑制了AgCl的溶解,但Cl-浓度增大使AgCl形成络合物:AgCl+Cl-═[AgCl2]-,
故答案为:Cl-抑制了AgCl的溶解,但Cl-浓度增大使AgCl形成络合物:AgCl+Cl-═[AgCl2]-;
(3)根据S(AgCl)>S(AgI)>S(Ag2S),并且沉淀向着更难溶的物质转化,可以设计实验方案是:向AgCl悬浊液中滴加KI稀溶液(0.1mol/L),固体由白色转化为黄色,再向悬浊液中滴加同浓度Na2S稀溶液(0.1mol/L),固体由黄色转化为黑色,
故答案为:向AgCl悬浊液中滴加KI稀溶液(0.1mol/L),固体由白色转化为黄色,再向悬浊液中滴加同浓度Na2S稀溶液(0.1mol/L),固体由黄色转化为黑色;
(4)氯化银能和氨水反应生成无色银氨溶液溶液,现象是:白色沉淀溶解,形成无色溶液,
实质为:AgCl+2NH3=Ag(NH3)2++Cl-,
故答案为:白色沉淀溶解,形成无色溶液;AgCl+2NH3=Ag(NH3)2++Cl-.
本题解析:
本题难度:一般
5、选择题 下列实验操作与预期实验目的或所得实验结论一致的是
选项
| 实验操作
| 实验目的或结论
|
A
| 某钾盐溶于盐酸,产生能使澄清石灰水变浑浊的无色无味气体
| 说明该钾盐是K2CO3
|
B
| 向含有少量FeCl3的MgCl2溶液中加入足量Mg(OH)2粉末,搅拌一段时间后过滤
| 除去MgCl2溶液中少量FeCl3
|
C
| 常温下,向饱和Na2CO3溶液中加少量BaSO4粉末,过滤,向洗净的沉淀中加稀盐酸,有气泡产生
| 说明常温下Ksp(BaCO3)<Ksp(BaSO4)
|
D
| C2H5OH与浓硫酸170 ℃共热,制得的气体通入酸性KMnO4溶液
| 检验制得气体是否为乙烯
|
参考答案:B
本题解析:A、某钾盐溶于盐酸,产生能使澄清石灰水变浑浊的无色无味气体,该钾盐可能含CO32-、HCO3-,故A错误;B、向含有少量FeCl3的MgCl2溶液中加入足量Mg(OH)2粉末,搅拌一段时间后过滤,Fe3+发生水解反应:Fe3++3H2O?Fe(OH)3+3H+,足量Mg(OH)2消耗H+促进Fe3+水解,使Fe3+完全水解成Fe(OH)3过滤除去,故B正确;C、常温下,向饱和Na2CO3溶液中加少量BaSO4粉末,部分BaSO4因饱和Na2CO3溶液中高浓CO32-转化BaCO3,因此向洗净的沉淀中加稀盐酸,有气泡产生,但是Ksp(BaCO3)>Ksp(BaSO4),故C错误;D、C2H5OH与制得的乙烯都有还原性,通入酸性KMnO4溶液都会褪色,故D错误。
考点:本题考查实验方案的设计与分析。
本题难度:一般