|
|
|
高中化学知识点总结《热化学方程式》考点巩固(2017年最新版)(七)
2017-07-10 17:28:20
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 已知下列热化学方程式:Zn(s)+1/2O2(g)=ZnO(s);△H=-351.1kJ·mol-1
Hg(l)+1/2O2(g)=HgO(s);△H=-90.7 kJ·mol-1,由此可知反应:
Zn(s)+HgO(s)=ZnO(s)+ Hg(l)的△H为。
A.△H=-1141.8 kJ·mol-1
B.△H=+260.4kJ·mol-1
C.△H=+441.8 kJ·mol-1
D.△H=-260.4 kJ·mol-1
|
2、选择题 已知下列热化学方程式:
Zn(s)+O2(g)=ZnO(s) ΔH=-Q1 kJ / mol
Hg(l)+O2(g)=HgO(s) ΔH=-Q2kJ / mol
Zn(s)+HgO(s)=Hg(l) +ZnO(s) ΔH=-Q3kJ / mol
Q3值为
A.Q2 - Q1
B.Q1+ Q2
C.Q1- Q2
D.-Q1- Q2
|
3、填空题 (10分) CO2和CH4是两种重要的温室气体,通过CH4和CO2反应来制造更高价值的化学品是目前的研究目标。
(1)250 ℃时,以镍合金为催化剂,向体积为4 L的密闭容器中通入6 mol CO2、6 mol CH4,发生如下反应:CO2(g)+CH4(g) 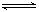
4、选择题 通常人们把拆开1 mol某化学键所吸收的能量看成该化学键的键能。现给出化学键的键能(见下表):
化学键
| H—H
| Cl—Cl
| Cl—H
|
键能/(kJ·mol-1)
| 436
| 243
| 431
|
请计算H2(g)+Cl2(g)===2HCl(g)的反应热( )
A.+862 kJ·mol-1 B.+679 kJ·mol-1
C.-183 kJ·mol-1 D.+183 kJ·mol-1
5、填空题 (14分)氮的化合物是一把双刃剑,它既是一种资源,又会给环境造成危害。
Ⅰ.氨气是一种重要的化工原料。
(1)NH3与CO2在120oC,催化剂作用下反应生成尿素:CO2(g) +2NH3(g) (NH2)2CO(s) +H2O(g),在密闭反应容器中,混合气体中NH3的含量变化关系如图所示:
(NH2)2CO(s) +H2O(g),在密闭反应容器中,混合气体中NH3的含量变化关系如图所示:

则A点的逆反应速率V(逆)(CO2) B点的正反应速率V(正)(CO2)(填“>”“=”或“<”),氨气的平衡转化率是 。
(2)将一定量的NH2COONH4(s)置于恒温密闭容器中,NH2COONH4(s) 2 NH3(g)+CO2(g),其分解达到平衡状态时,容器内混合气体的平均相对分子质量为 。该反应的化学平衡常数的表达式为________。
2 NH3(g)+CO2(g),其分解达到平衡状态时,容器内混合气体的平均相对分子质量为 。该反应的化学平衡常数的表达式为________。
Ⅱ.氮的氧化物会污染环境。
(3)采取还原法,用炭粉可将氮的氧化物还原。
已知:N2(g)+O2(g)=2NO(g) △H=" +180.6" kJ·mol-1
C(s)+O2(g)=CO2(g) △H= —393.5 kJ·mol-1
写出炭粉还原一氧化氮的热化学反应方程式 。
(4)若用Na2CO3溶液吸收NO2可生成CO2,9.2gNO2和Na2CO3溶液完全反应时转移电子0.1mol,则此反应的离子反应方程式为________。若生成的CO2完全逸出,所得溶液中的离子浓度大小关系为________。
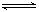
 (NH2)2CO(s) +H2O(g),在密闭反应容器中,混合气体中NH3的含量变化关系如图所示:
(NH2)2CO(s) +H2O(g),在密闭反应容器中,混合气体中NH3的含量变化关系如图所示:
 2 NH3(g)+CO2(g),其分解达到平衡状态时,容器内混合气体的平均相对分子质量为 。该反应的化学平衡常数的表达式为________。
2 NH3(g)+CO2(g),其分解达到平衡状态时,容器内混合气体的平均相对分子质量为 。该反应的化学平衡常数的表达式为________。