微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 铝和氢氧化钾都是重要的工业产品。请回答
(1)工业冶炼铝的化学方程式是__________________________________。
(2)铝与氢氧化钾溶液反应的离子方程式是__________________________________。
(3)工业品氢氧化钾的溶液中含有某些含氧酸根杂质,可用离子交换膜法电解提纯。电解槽内装有阳离子交换膜(只允许阳离子通过),其工作原理如图所示。
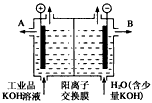
①该电解槽的阳极反应式是__________________________________。
②通电开始后,阴极附近溶液pH会增大,请简述原因________________________________。
③除去杂质后得氢氧化钾溶液从液体出口____________(填写A或B)导出。
2、填空题 (12分)某化学兴趣小组对电化学问题进行了实验探究。
I 利用下图装置探究金属的防护措施,实验现象是锌电极不断溶解,铁电极表面有气泡产生。

(1)写出负极的电极反应:_____________。
(2)某学生认为,铁电极可能参与反应,并对产物作出假设:
假设1:铁参与反应,被氧化生成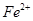 ;
;
假设2:铁参与反应,被氧化生成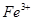 ;
;
假设3:__________________________。
(3)为了探究假设1、2,他进行如下操作:
①取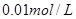
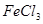 溶液
溶液 于试管中,加入过量铁粉;
于试管中,加入过量铁粉;
②取操作①试管的上层清液加入2滴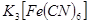 溶液,生成蓝色沉淀;
溶液,生成蓝色沉淀;
③取少量正极附近溶液加入2滴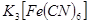 溶液,未见蓝色沉淀生成;
溶液,未见蓝色沉淀生成;
④取少量正极附近溶液加入2滴 溶液,未见溶液变红。
溶液,未见溶液变红。
据②、③、④现象得出的结论是_____________。
II 利用下图装置做电解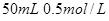 的
的 溶液实验。
溶液实验。

实验记录:
A.阳极上有黄绿色气体产生,该气体使湿润的碘化钾淀粉试纸先变蓝后褪色(提示: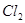 氧化性大于
氧化性大于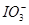 且含
且含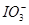 的溶液是无色的);
的溶液是无色的);
B.电解一段时间后,阴极表面除有铜吸附外,还出现了少量气泡和浅蓝色固体。
(1)分析实验记录A中试纸颜色变化,用离子方程式解释:①____________;②_____________。
(2)分析实验记录B中浅蓝色固体可能是_______________(写化学式),试分析生成该物质的原因___________。
3、选择题 用铂电极电解CuSO4和KNO3的混合液500mL,经过一段时间 后,两极均得到标况下11.2L气体,则原混合液中CuSO4的物质的量浓度为(?)
后,两极均得到标况下11.2L气体,则原混合液中CuSO4的物质的量浓度为(?)
A.0.5mol·L-1
B.0.8mol·L-1
C.1.0mol·L-1
D.1.5mol·L-1
4、填空题 如图甲、乙是电化学实验装置。
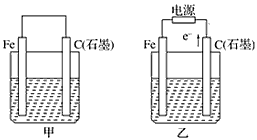
(1)若甲、乙两烧杯中均盛有NaCl溶液。
①甲中石墨棒上的电极反应式为_________________________;
②乙中总反应的离子方程式为________________________;
③将湿润的淀粉KI试纸放在乙烧杯上方,发现试纸先变蓝后褪色,这是因为过量的Cl2氧化了生成的I2。若反应中Cl2和I2的物质的量之比为5 ∶1,且生成两种酸,该反应的化学方程式为_________________。
(2)若甲、乙两烧杯中均盛有CuSO4溶液。
①甲中铁棒上的电极反应式为______________________;
②如果起始时乙中盛有200 mL pH=5的CuSO4溶液(25℃),一段时间后溶液的pH变为1,若要使溶液恢复到电解前的状态,可向溶液中加入________(填写物质的化学式)________g。
5、填空题 工业上利用含有一定浓度的I2和CuSO4溶液的工业废水制备饲料添加剂Ca(IO3)2,其生产流程如下:
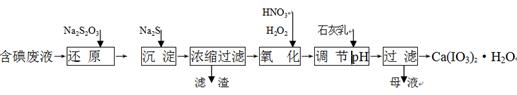
已知:Ca(IO3)2微溶于水,溶于硝酸;Ksp(CuI)=1.1×10-12, Ksp(Cu2S)=2.5×10-48;
氧化性: HNO3>IO3—>H2O2
(1)“还原”过程中主要反应的化学方程式为:2Na2S2O3+I2 = + 2NaI。
(2)在还原过程还伴随有CuI生成,写出加入Na2S的离子反应方程式 。
(3)在氧化过程中先加入H2O2再加入浓硝酸,而不直接加入浓硝酸的目的是 。
(4)加入的石灰乳在溶液中反应而得到Ca(IO3)2,则要调节pH至 (填“酸性” 或“中性”或“碱性”),原因是 。
(5)Ca(IO3)2也可用电化学氧化法制取:先充分电解KI溶液,然后在电解后的溶液中加入CaCl2,最后过滤得到Ca(IO3)2。写出电解时阳极发生的电极反应方程式 ,用该方法制取Ca(IO3)2,每1kg碘化钾理论上可生产纯度为97.8%Ca(IO3)2的质量为 ____kg(计算结果保留3位有效数字)。