微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 铝和氢氧化钾都是重要的工业产品。请回答
(1)工业冶炼铝的化学方程式是__________________________________。
(2)铝与氢氧化钾溶液反应的离子方程式是__________________________________。
(3)工业品氢氧化钾的溶液中含有某些含氧酸根杂质,可用离子交换膜法电解提纯。电解槽内装有阳离子交换膜(只允许阳离子通过),其工作原理如图所示。
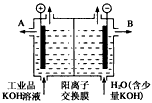
①该电解槽的阳极反应式是__________________________________。
②通电开始后,阴极附近溶液pH会增大,请简述原因________________________________。
③除去杂质后得氢氧化钾溶液从液体出口____________(填写A或B)导出。
参考答案:(1)2Al2O3 4Al+3O2↑
4Al+3O2↑
(2)2Al+2H2O+2OH-==2AlO2-+3H2↑
(3)①4OH--4e-==O2↑+2H2O;②H+放电,促进水的电离,OH-浓度增大;③B
本题解析:
本题难度:一般
2、填空题 (12分)某化学兴趣小组对电化学问题进行了实验探究。
I 利用下图装置探究金属的防护措施,实验现象是锌电极不断溶解,铁电极表面有气泡产生。

(1)写出负极的电极反应:_____________。
(2)某学生认为,铁电极可能参与反应,并对产物作出假设:
假设1:铁参与反应,被氧化生成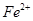 ;
;
假设2:铁参与反应,被氧化生成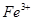 ;
;
假设3:__________________________。
(3)为了探究假设1、2,他进行如下操作:
①取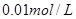
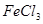 溶液
溶液 于试管中,加入过量铁粉;
于试管中,加入过量铁粉;
②取操作①试管的上层清液加入2滴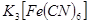 溶液,生成蓝色沉淀;
溶液,生成蓝色沉淀;
③取少量正极附近溶液加入2滴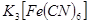 溶液,未见蓝色沉淀生成;
溶液,未见蓝色沉淀生成;
④取少量正极附近溶液加入2滴 溶液,未见溶液变红。
溶液,未见溶液变红。
据②、③、④现象得出的结论是_____________。
II 利用下图装置做电解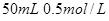 的
的 溶液实验。
溶液实验。

实验记录:
A.阳极上有黄绿色气体产生,该气体使湿润的碘化钾淀粉试纸先变蓝后褪色(提示: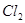 氧化性大于
氧化性大于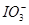 且含
且含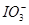 的溶液是无色的);
的溶液是无色的);
B.电解一段时间后,阴极表面除有铜吸附外,还出现了少量气泡和浅蓝色固体。
(1)分析实验记录A中试纸颜色变化,用离子方程式解释:①____________;②_____________。
(2)分析实验记录B中浅蓝色固体可能是_______________(写化学式),试分析生成该物质的原因___________。
参考答案:(共12分)
I (1)Zn—2e一=Zn2+(1分)
(2)铁参与反应,被氧化生成Fe2+和Fe3+(1分)
(3)正极附近溶液不含Fe2+和Fe3+(2分)
II (1)①2I-+Cl2=2Cl-+I2(2分)
②5Cl2+ I2+6H2O=10Cl-+2IO3-+12H+(2分)
(2)Cu(OH)2(2分)电解较长时间后,Cu2+浓度下降,H+开始放电,溶液pH增大,Cu2+转化为Cu(OH)2(2分)
本题解析:I.(1)该装置是原电池,Fe作正极,产生氢气,Zn作负极,失去电子生成锌离子,电极反应式为Zn—2e一=Zn2+;
(2)结合Fe被氧化产物的可能性,所以第三种假设为铁参与反应,被氧化生成Fe2+和Fe3+;
(3)根据反应的现象,与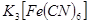 反应产生蓝色沉淀的是亚铁离子,据③考证正极附近溶液中一定不存在亚铁离子;铁离子与KSCN溶液反应,溶液变红色,而④正极附近的溶液,未变红色,所以正极无铁离子,所以据②、③、④现象得出的结论是正极附近溶液不含Fe2+和Fe3+;
反应产生蓝色沉淀的是亚铁离子,据③考证正极附近溶液中一定不存在亚铁离子;铁离子与KSCN溶液反应,溶液变红色,而④正极附近的溶液,未变红色,所以正极无铁离子,所以据②、③、④现象得出的结论是正极附近溶液不含Fe2+和Fe3+;
II.(1)A中的试纸先变蓝色,说明有碘单质生成,后褪色,说明碘单质消失,所以开始的反应是阳极产生的黄绿色气体氯气先氧化碘离子为碘单质,2I-+Cl2=2Cl-+I2,因为氯气的氧化性大于碘酸根离子的氧化性,所以氯气继续氧化碘单质为碘酸根离子,所以蓝色褪去,离子方程式是5Cl2+ I2+6H2O=10Cl-+2IO3-+12H+;
(2)电解氯化铜溶液,阴极先是铜离子放电生成Cu单质,有红色固体析出,随反应的进行,铜离子的浓度减小,氢离子开始放电,使氢氧根离子浓度增大,从而与铜离子反应生成氢氧化铜沉淀,所以B中浅蓝色固体可能是Cu(OH)2。
考点:考查原电池反应原理的应用,反应现象的分析,离子的检验
本题难度:困难
3、选择题 用铂电极电解CuSO4和KNO3的混合液500mL,经过一段时间 后,两极均得到标况下11.2L气体,则原混合液中CuSO4的物质的量浓度为(?)
后,两极均得到标况下11.2L气体,则原混合液中CuSO4的物质的量浓度为(?)
A.0.5mol·L-1
B.0.8mol·L-1
C.1.0mol·L-1
D.1.5mol·L-1
参考答案:C
本题解析:略
本题难度:简单
4、填空题 如图甲、乙是电化学实验装置。
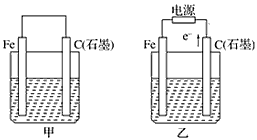
(1)若甲、乙两烧杯中均盛有NaCl溶液。
①甲中石墨棒上的电极反应式为_________________________;
②乙中总反应的离子方程式为________________________;
③将湿润的淀粉KI试纸放在乙烧杯上方,发现试纸先变蓝后褪色,这是因为过量的Cl2氧化了生成的I2。若反应中Cl2和I2的物质的量之比为5 ∶1,且生成两种酸,该反应的化学方程式为_________________。
(2)若甲、乙两烧杯中均盛有CuSO4溶液。
①甲中铁棒上的电极反应式为______________________;
②如果起始时乙中盛有200 mL pH=5的CuSO4溶液(25℃),一段时间后溶液的pH变为1,若要使溶液恢复到电解前的状态,可向溶液中加入________(填写物质的化学式)________g。
参考答案:(1)①O2+2H2O+4e-==4OH-;②2Cl-+2H2O 2OH-+H2↑+Cl2↑;③5Cl2+I2+6H2O==2HIO3+10HCl
2OH-+H2↑+Cl2↑;③5Cl2+I2+6H2O==2HIO3+10HCl
(2)①Fe-2e-==Fe2+;②CuO;0.8(或CuCO3;1.24)
本题解析:
本题难度:一般
5、填空题 工业上利用含有一定浓度的I2和CuSO4溶液的工业废水制备饲料添加剂Ca(IO3)2,其生产流程如下:
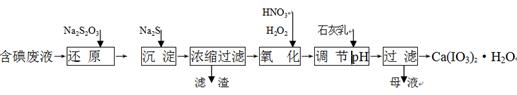
已知:Ca(IO3)2微溶于水,溶于硝酸;Ksp(CuI)=1.1×10-12, Ksp(Cu2S)=2.5×10-48;
氧化性: HNO3>IO3—>H2O2
(1)“还原”过程中主要反应的化学方程式为:2Na2S2O3+I2 = + 2NaI。
(2)在还原过程还伴随有CuI生成,写出加入Na2S的离子反应方程式 。
(3)在氧化过程中先加入H2O2再加入浓硝酸,而不直接加入浓硝酸的目的是 。
(4)加入的石灰乳在溶液中反应而得到Ca(IO3)2,则要调节pH至 (填“酸性” 或“中性”或“碱性”),原因是 。
(5)Ca(IO3)2也可用电化学氧化法制取:先充分电解KI溶液,然后在电解后的溶液中加入CaCl2,最后过滤得到Ca(IO3)2。写出电解时阳极发生的电极反应方程式 ,用该方法制取Ca(IO3)2,每1kg碘化钾理论上可生产纯度为97.8%Ca(IO3)2的质量为 ____kg(计算结果保留3位有效数字)。
参考答案:(1) Na2S4O6 (2分)
(2)2CuI(s)+S2—=Cu2S(s)+2I— (3分)
(3)减少氧化过程中生成的氮的氧化物的污染 (2分)
(4)中性 (2分)Ca(IO3)2在硝酸溶液中溶解,故要中和过量的酸;在碱性溶液中,会混有微溶的Ca(OH)2造成产品不纯。 (2分)
(5)3H2O+I— -6e—=IO3—+6H+ (3分) ; 1.20(2分)
本题解析: (1)该过程称之为还原过程,可以肯定发生了氧化还原反应,所以根据方程式中的I的化合价降低可以知道,Na2S2O3 的中S的化合价升高,再根据Na、O原子守恒可以配平该方程式为2Na2S2O3+I2 = Na2S4O6+ 2NaI,还可以根据写出的化学方程式用电子得失配平验证。此处的难点关键在于缺项物质为中学阶段没接触过的连四硫酸钠,所以可能会出现想不到或是不敢写的情况,只要大胆利用所学的原则配平就可以了。
(2)还原过程中已经说明有沉淀CuI生成了,所以加入Na2S还会发生反应,则应该是通过已知条件中的沉淀溶解平衡常数进行比较得出结论,比较之下Cu2S比 CuI更加难溶,所以此时会发生沉淀转化,所以发生的反应方程式书写要按照沉淀溶解平衡的格式书写,方程式为2CuI(s)+S2—(aq)=Cu2S(s)+2I—(aq)。
(3)氧化步骤加入的H2O2 和浓硝酸起到氧化的目的,但是浓硝酸参与的反应容易产生氮氧化物污染环境,所以先加入过氧化氢。由于氧化性顺序HNO3>IO3—>H2O2 ,所以加入的过氧化氢只能把I-氧化为IO3- ,要使I2继续被氧化为IO3- ,还需要再加入浓硝酸,使浓硝酸反应更加完全,从而减少过程中氮氧化物的污染。
(4)加入石灰乳目的是反应得到Ca(IO3)2 ,且通过操作可以看出反应后要使Ca(IO3)2 尽可能多得以晶体形式析出,而Ca(IO3)2溶于硝酸,所以必须调节pH值把过量的硝酸中和掉,且加入的石灰乳不能过量,过量则会混入石灰乳沉淀杂质,所以应该调节pH至中性。
(5)用KI溶液电解制备Ca(IO3)2 溶液,则I-需要发生氧化反应在阳极放电生成IO3-,电解液是非碱性的,所以根据O原子守恒,IO3—中的O一定来源于H2O中,从而生成了H+,所以电极反应式为:3H2O+I— -6e—=IO3—+6H+ ;计算碘化钾的质量可以采用I原子守恒计算,所以有1/2n(KI)= n(Ca(IO3)2)=1000/166mol,m产品=M(Ca(IO3)2)×n(Ca(IO3)2)÷97.8%=390g/mol×1000/166mol÷97.8%≈1200g=1.20kg。
考点:本题考查的是化学工艺流程,涉及到了陌生的氧化还原反应缺项配平、沉淀转化、环境问题、PH调节、电化学基础、转化计算等内容。
本题难度:困难