微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 电解原理在化学工业中有广泛应用。下图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连。

请回答以下问题:
(1)若X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞试液,则
①电解池中X极上的电极反应式为 。
在X极附近观察到的现象是 。
②Y电极上的电极反应式为 ,
检验该电极反应产物的方法是 。
(2)如要用电解方法精炼粗铜,电解液a选用CuSO4溶液,则
①X电极的材料是 ,电极反应式是 。
②Y电极的材料是 ,电极反应式是 。
(说明:杂质发生的电极反应不必写出)
参考答案:⑴①2H+ + 2e - = H2↑(2分) 放出气体,溶液变红。(2分)
②2Cl - - 2e - = Cl2 ↑(2分)
把湿润的碘化钾淀粉试纸放在Y电极附近,试纸变蓝色。(2分)
⑵①纯铜(或精铜)(1分) Cu2+ + 2e - =" Cu" (2分)
②粗铜(1分) Cu - 2e - = Cu2+ (2分)
本题解析:(1)X极为阴极,氢离子放电,产生氢气,故X极附近存在着由水电离出来的氢氧根离子,遇到酚酞,溶液变红;Y极为阳极,氯离子放电,产生氯气,氯气的检验方法为:把湿润的碘化钾淀粉试纸放在Y电极附近,试纸变蓝色;(2)精练粗铜,阴极为纯铜,即X极,发生还原反应,电极反应式为Cu2+ + 2e - = Cu;阳极为粗铜,即Y极,发生氧化反应,电极反应式为Cu - 2e - = Cu2+。
考点:电解池
点评:电解池是历年高考常考知识点,注重考查学生分析问题、解决问题的能力。
本题难度:一般
2、简答题 M、R都是生活中常见的金属单质,其中R是用量最多的金属.甲、乙是化合物,其中甲是黑色晶体,可由R在X中燃烧得到.
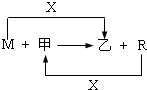
(1)M与甲在高温下反应的化学方程式是______.
(2)电解法制R低价氢氧化物的装置如图.a是4mol?L-1NaCl、1mol?L-1NaOH的混合溶液.

①配制a时需要除去蒸馏水中溶解的O2,常采用______的方法.
②石墨电极应与电源的______(填“正”或“负”)极相连接,通电后,R电极附近的现象是______,R极的电极反应式是______.
③停止实验一段时间后,在R极上部有红褐色物质产生,反应的化学方程式是______.
(3)把R的某氧化物粉末与M粉末混合后分成两等份.一份在高温下恰好完全反应后,再与足量盐酸反应;另一份直接放入足量的烧碱溶液中充分反应.前后两种情况下生成的气体质量比是a:b,则R的氧化物的化学式是______.
参考答案:(1)根据题意和图示内容,R是用量最多的金属,可知R是金属铁,甲是黑色晶体,可推知甲是四氧化三铁,能将铁的氧化物中的铁置换出来的反应原理是铝热反应原理,
故答案为:8Al+3Fe3O4?高温?.?4Al2O3+9Fe;
(2)①氢氧化亚铁的制取,必须避开空气中的氧气,加热煮沸溶液能将溶液中的气体物质除去,故答案为:煮沸;
②电解法制取氢氧化亚铁时,金属铁必须作阳极,在该电极上,金属铁失电子,所以石墨做阴极,石墨电极应与电源的负极相连,在阳极附近生成的亚铁离子会和氢氧根反应生成氢氧化亚铁白色沉淀,故答案为:负;生成白色沉淀;Fe-2e-+2OH-=Fe(OH)2↓;
③氢氧化亚铁沉淀很容易被空气氧化为氢氧化铁,反应的化学方程式是:4Fe(OH)2 +O2+2H2O═4Fe(OH)3,故答案为:4Fe(OH)2 +O2+2H2O═4Fe(OH)3;
(3)生成的氢气质量比是a:b,也就是物质的量之比为a:b,第一份在高温下恰好完全反应后,再与足量盐酸反应,则Fe+2HCl=FeCl2+H2↑,设产生的氢气物质的量为a,则消耗金属铁的物质的量为a,另一份直接放入足量的烧碱溶液中充分反应,即2Al+6H2O+2NaOH=2Na[Al(OH)4]+3H2↑,产生的氢气物质的量为b,则消耗金属铝的量为2b3,在铁的氧化物和金属铝的反应中,设反应为:FexOy+Al→Al2O3+Fe,根据原子守恒,金属铁的物质的量为a,则x=a,金属铝的物质的量为2b3时,则氧化铝中的氧原子物质的量为b,即y=b,
故答案为:FeaOb.
本题解析:
本题难度:一般
3、选择题 氯碱工业是一种高耗能产业,一种将燃料电池与电解池组合的新工艺可节能30%以上,下图是该工艺图示(电极未标出)。
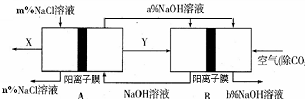
下列说法正确的是
A.X为H2,Y为Cl2
B.A池为电解池,且m<n
C.B池为燃料电池,且a<b
D.该工艺优点是燃料电池提供电能且能提高烧碱产品的浓度
参考答案:CD
本题解析:A池为电解池,B为燃料电池,燃料电池的工作原理为:燃料进入负极、空气(氧气)进入正极;
A错,X为Cl2,Y为H2;B错,在电解氯化钠溶液时,氯离子不断放电生成氯气,使溶液中氯离子浓度减小,所以A池为电解池,且n<m;C正确,在氢氧燃料电池中,工作时不断生成水,使溶液中氢氧化钠的浓度减小,即B池为燃料电池,且a<b;D正确;
本题难度:一般
4、选择题 用质量均为100 g的铜作电极,电解硝酸银溶液,电解一段时间后,两电极的质量差为28 g,此时两电极的质量分别为
A.阳极100 g,阴极128 g
B.阳极93.6 g,阴极121.6 g
C.阳极91.0 g,阴极119.0 g
D.阳极86.0 g,阴极114.0 g
参考答案:B
本题解析:由电极反应:阳极:Cu-2e-=Cu2+?阴极:Ag++e-=Ag
可知阳极质量减轻,而阴极质量增加,由差量法可求解

故最终阳极质量为100-6.4=93.6 g,阴极质量为100+21.6g=121.6g
答案为B
本题难度:一般
5、填空题 X、Y、Z、L、M五种元素的原子序数依次增大。X、Y、Z、L是组成蛋白质的基础元素,M是地壳中含量最高的金属元素。
回答下列问题:
(1)L的元素符号为________ ;M在元素周期表中的位置为________________;五种元素的原子半径从大到小的顺序是____________________(用元素符号表示)。
(2)Z、X两元素按原子数目比l∶3和2∶4构成分子A和B,A的电子式为___,B的结构式为____________。
(3)硒(se)是人体必需的微量元素,与L同一主族,Se原子比L原子多两个电子层,则Se的原子序数为_______,其最高价氧化物对应的水化物化学式为_______。该族2 ~ 5周期元素单质分别与H2反应生成l mol气态氢化物的反应热如下,表示生成1 mol硒化氢反应热的是__________(填字母代号)。
a.+997 mol·L-1 b.+297 mol·L-1 c.-206 mol·L-1 d.-2418 kJ·mol-1
(4)用M单质作阳极,石墨作阴极,NaHCO3溶液作电解液进行电解,生成难溶物R,R受热分解生成化合物Q 。写出阳极生成R的电极反应式:______________;由R生成Q的化学方程式:_______________________________________________。
参考答案:(1)O;第三周第ⅢA族;Al>C>N>O>H
(2)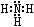 ;
;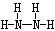
(3)34;H2SeO4;b
(4)?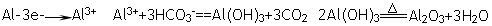
本题解析:
本题难度:一般