微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 已知在1×105?Pa,298?K条件下,4g?氢气燃烧生成液态水放出572?kJ热量,下列表示氢气燃烧的热化学方程式的是
[? ]
A.H2O(g)?=?H2(g)+1/2O2(g)?△H=+286kJ/mol
B.2H2(g)+?O2(g)=2H2O(l)?△H=-572kJ/mol
C.H2(g)+?1/2O2(g)=?H2O(g)?△H=-286kJ/mol
D.H2(g)+1/2O2(g)=H2O(l)?△H=+286?kJ/mol
参考答案:B
本题解析:
本题难度:简单
2、填空题 (8分)已知下列热化学方程式:
①H2(g)+ O2(g)===H2O(l)ΔH=-285.8 kJ/mol
O2(g)===H2O(l)ΔH=-285.8 kJ/mol
②H2(g)+ O2(g)===H2O(g) ΔH=-241.8 kJ/mol
O2(g)===H2O(g) ΔH=-241.8 kJ/mol
③C(s)+ O2(g)===CO(g)ΔH=-110.5 kJ/mol
O2(g)===CO(g)ΔH=-110.5 kJ/mol
④C(s)+O2(g)===CO2(g)ΔH=-393.5 kJ/mol
回答下列各问题:
(1)上述反应中属于放热反应的是 。
(2)C的燃烧热为 。
(3)CO的燃烧热为__________;其热化学方程式为__________________________。
参考答案:(1)①②③④ 。 (2)393.5kJ/mol 。(3) 283.0kJ/mol;CO(g) +1/2 O2 (g) = CO2 (g) △H=-283.0kJ/mol。
本题解析:
试题解析:(1)在热化学方程式中吸热为正放热为负,属于放热反应的是①②③④;(2)根据燃烧热的定义,碳燃烧生成的两种氧化物中,二氧化碳更稳定,故其燃烧的热化学方程式为:C(s)+O2(g)
本题难度:一般
3、填空题 研究CO2的利用对促进低碳社会的构建具有重要意义。
(1)将CO2与焦炭作用生成CO,CO可用于炼铁等。
已知:Fe2O3(s) + 3C(石墨) =" 2Fe(s)" + 3CO(g) △H 1 =" +489.0" kJ·mol-1
C(石墨) +CO2(g) = 2CO(g) △H 2 =" +172.5" kJ·mol-1
则CO还原Fe2O3(s)的热化学方程式为 。
(2)二氧化碳合成甲醇是碳减排的新方向,将CO2转化为甲醇的热化学方程式
CO2(g) +3H2(g) CH3OH(g) +H2O(g) △H
CH3OH(g) +H2O(g) △H
①该反应的平衡常数表达式为K= 。
②取一定体积CO2和H2的混合气体(物质的量之比为1∶3),加入恒容密闭容器中,发生上述反应。反应过程中测得甲醇的体积分数φ(CH3OH)与反应温度T的关系如图A所示,则该反应的ΔH 0(填“>”、“<”或“=”)。

③在两种不同条件下发生反应,测得CH3OH的物质的量随时间变化如图B所示,曲线I、Ⅱ对应的平衡常数大小关系为KⅠ KⅡ(填“>” 或“<”)。
(3)以CO2为原料还可以合成多种物质。①工业上尿素[CO(NH2)2]由CO2和NH3在一定条件下合成,其反应方程式为 。当氨碳比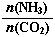 =3,达平衡时CO2的转化率为60%,则NH3的平衡转化率为 。
=3,达平衡时CO2的转化率为60%,则NH3的平衡转化率为 。
②用硫酸溶液作电解质进行电解,CO2在电极上可转化为甲烷,该电极反应的方程式为 。
参考答案:(1)Fe2O3(s)+3CO(g) = 2Fe(s)+3CO2(g) △H = —28.5 kJ·mol-1(3分)(方程式、状态正确给1分,△H符号、数据、单位正确给2分)
(2)①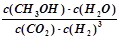 (2分) ②<(2分) ③>(2分)
(2分) ②<(2分) ③>(2分)
(3)①2NH3+CO2 CO(NH2)2+H2O(2分)(配平错扣1分)
CO(NH2)2+H2O(2分)(配平错扣1分)
40%或0.4(2分)
②CO2+8e—+8H+=CH4+2H2O(3分)(配平错扣2分)
本题解析:(1)根据已知方程式和盖斯定律,所求方程式可由①-②×3得,△H = △H 1-3△H 2 =" +489.0" kJ·mol-1-3×172.5 kJ·mol-1 =—28.5 kJ·mol-1 ,所以CO还原氧化铁的热化学方程式为:Fe2O3(s)+3CO(g) = 2Fe(s)+3CO2(g) △H = —28.5 kJ·mol-1 。
(2)①根据给出的热化学方程式可得出该反应的平衡常数表达式为:K= 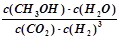 ,
,
②图A中生成物甲醇的体积分数随着温度升高呈现出先增大后减小的变化,可以分析为达到最高点之前反应并未达到平衡,随温度升高反应速率加快,甲醇含量不断增大;当达到一定值时,反应达到平衡,此时再升高温度平衡发生移动,甲醇含量下降可以看出平衡逆向移动,所以该反应正反应为放热反应,ΔH<0。
③图B中不同条件下反应达到平衡时得到的甲醇的物质的量I>Ⅱ,所以I条件下的反应进行程度更大,所以KⅠ>KⅡ 。
(3)①工业用CO2和NH3在一定条件下合成尿素,该反应方程式可以由C:N比进行配平,所以方程式为: 2NH3+CO2 CO(NH2)2+H2O;根据方程式中的系数可知,反应的n(NH3)=2n(CO2),而总的n(NH3)=3n(CO2),所以假设的CO2有1mol,则有n(NH3)=3n(CO2)=3mol,反应的n(NH3)=2×1×0.6 =1.2mol所以氨气的平衡转化率为40%。
CO(NH2)2+H2O;根据方程式中的系数可知,反应的n(NH3)=2n(CO2),而总的n(NH3)=3n(CO2),所以假设的CO2有1mol,则有n(NH3)=3n(CO2)=3mol,反应的n(NH3)=2×1×0.6 =1.2mol所以氨气的平衡转化率为40%。
②在酸性电介质中发生电解反应,考虑氢离子参加反应,CO2在电极上得电子被还原为甲烷,有水生成,所以电极反应式为:CO2+8e—+8H+=CH4+2H2O。
考点:本题考查的是化学反应原理的知识,主要涉及热化学方程式的书写、盖斯定律的应用、平衡常数的表达、焓变的大小判断、平衡图像的理解等知识。
本题难度:困难
4、填空题 白磷(P4)是一种常见的晶体,可用于制备较纯的磷酸。
(1)白磷是____________晶体,31g白磷与足量的氧气完全燃烧释放出745.5kJ的热量,请写出白磷燃烧的热化学反应方程__________________________
(2)已知白磷和氯酸溶液可发生如下反应:
①____P4 +____HClO3+____ →___HCl +___H3PO4配平并完成上述反应方程式;
→___HCl +___H3PO4配平并完成上述反应方程式;
②该反应的氧化剂是______________。
参考答案:(1)分子;P4(s)+5O2(g) ===2P2O5(s);△H=-2982kJ/mol
(2)①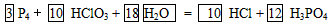 ;②HClO3
;②HClO3
本题解析:
本题难度:一般
5、填空题 (共12分)(1)火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态双氧水。当把0.4mol液态肼和0.8mol H2O2混合反应,生成氮气和水蒸气,放出257.7kJ的热量(相当于25℃、101 kPa下测得的热量)。
①反应的热化学方程式为 。
②又已知H2O(l)=H2O(g) ΔH=+44kJ/mol。则16g液态肼与液态双氧水反应生成液态水时放出的热量是 kJ。
③此反应用于火箭推进,除释放大量热和快速产生大量气体外,还有一个很大的优点是 。
(2)盖斯定律在生产和科学研究中有很重要的意义。有些反应的反应热虽然无法直接测得,但可通过间接的方法测定。现根据下列3个热化学反应方程式:
Fe2O3(s)+3CO(g)="=" 2Fe(s)+3CO2(g) △H=—24.8kJ/mol
3Fe2O3(s)+ CO(g)==2Fe3O4(s)+ CO2(g) △H=—47.4kJ/mol
Fe3O4(s)+CO(g)==3FeO(s)+CO2(g) △H= +640.5kJ/mol
写出CO气体还原FeO固体得到Fe 固体和CO2气体的热化学反应方程式:
_________________
参考答案:(1)①N2H4(l)+2H2O2(l) = N2(g) +4H2O(g) △H=-644.25 KJ/mol (3分)
② 410.125 (3分)
③产物不会造成环境污染。(3分)
(2)CO(g)+FeO(s) ="=" Fe(s)+CO2(g) △H=
本题解析:
本题难度:一般