微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、计算题 (6分)某温度下,将一定量密度为1.15 g·cm-3的NaCl溶液用石墨电极通电电解,设NaCl恰好完全反应,且无其他反应发生,得到的溶液中氧元素的质量分数为80%。
(1)求电解后溶液中溶质与溶剂的物质的量之比。
(2)求原NaCl溶液的物质的量浓度。
参考答案:(1)1∶10?(2)4.48 mol·L-1
本题解析:(1)设食盐水中含NaCl x mol,电解后溶液中含有y mol H2O。
2NaCl+2H2O 2NaOH+H2↑+Cl2↑
2NaOH+H2↑+Cl2↑
2 mol ?2 mol? 2 mol
x mol?x mol? x mol
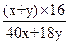 ×100%="80%?" 解得:x∶y=1∶10。
×100%="80%?" 解得:x∶y=1∶10。
(2)原NaCl溶液的物质的量浓度:
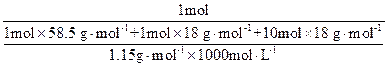
="4.48" mol·L-1。
本题难度:简单
2、选择题 常温下,浓度均为0.1 mol/L 的下列四种盐溶液,其pH测定如下表所示:
序号
| ①
| ②
| ③
| ④
|
溶液
| CH3COONa
| NaHCO3
| Na2CO3
| NaClO
|
pH
| 8.8
| 9.7
| 11.6
| 10.3
|
下列说法正确的是?
A.四种溶液中,水的电离程度①>②>④>③
B.Na2CO3和NaHCO3溶液中,粒子种类相同
C.将等浓度的CH3COOH和HClO溶液比较,pH小的是HClO
D.Na2CO3溶液中, c(Na+) = c(CO32-)+c(HCO3-)+c(H2CO3)
参考答案:B
本题解析:水解程度越大,水电离程度越大。水的电离程度③>④>②>①,A错;Na2CO3和NaHCO3溶液中都存在着H+、OH-、CO32-、HCO3-、H2CO3、Na+、H2O,B正确;醋酸的酸性强于次氯酸,在等物质的量浓度相等下,pH小的是醋酸,C错;在碳酸钠中钠是碳的2倍,D错;答案选B。
本题难度:一般
3、选择题 部分弱酸的电离平衡常数如下表:
弱酸
| HCOOH
| HCN
| H2CO3
|
电离平衡常数
(25℃)
| Ka=1.77×10-4
| Ka=4.9×10-10
| Ka1=4.3×10-7
Ka2=5.6×10-11
|
下列选项正确的是
A. 2CN-+H2O+CO2=2HCN+CO32-
B. 中和等体积、等pH的HCOOH和HCN消耗NaOH的量前者小于后者
C. 物质的量浓度相等的HCOONa和KCN溶液中,c(Na+)-c(HCOO-) < c(K+)-c(CN-)
D. c(NH4+) 相等的HCOONH4溶液、NH4CN溶液、NH4HCO3溶液中,
c(NH4HCO3)>c(NH4CN) >c(HCOONH4)
参考答案:BC
本题解析:A、氢氰酸的电离平衡常数小于碳酸而大于碳酸氢根离子,所以氢氰酸酸性小于碳酸而大于碳酸氢根离子,根据强酸制取弱酸知碳酸和氰化物的盐反应生成氢氰酸和碳酸氢盐,离子方程式为CN-+H2O+CO2═HCN+HCO3-,错误;B、因为HCOOH的电离平衡常数大于HCN的电离平衡常数,所以等pH的HCOOH和HCN,HCN的浓度大,因此中和等体积、等pH的HCOOH和HCN消耗NaOH的量前者小于后者,正确;C、根据物料守恒可得两溶液分别存在:c(Na+)-c(HCOO-)=c(HCOOH),c(K+)-c(CN-)=c(HCN),根据越弱越水解的规律,c(HCOOH)< c(HCN),则c(Na+)-c(HCOO-) < c(K+)-c(CN-),正确;D、根据越弱越水解的规律,c(NH4+) 相等的HCOONH4溶液、NH4CN溶液、NH4HCO3溶液中,c(NH4CN) > c(NH4HCO3) c(HCOONH4),错误。
本题难度:一般
4、选择题 已知同温同浓度时①H2CO3比H2S电离度大,②H2S比HCO3-电离度大,则下列反应不正确的是
[? ]
A. Na2CO3+H2S==NaHCO3+NaHS
B. Na2S+H2O+CO2==NaHS+NaHCO3
C. 2NaHCO3+H2S==Na2S+2H2O+2CO2
D. NaHS+H2O+CO2==NaHCO3+H2S
参考答案:C
本题解析:
本题难度:一般
5、选择题
A.1.0×10-7 mol·L-1
B.1.0×10-6 mol·L-1
C.1.0×10-2 mol·L-1
D.1.0×10-12 mol·L-1
参考答案:CD
本题解析:考查学生对不同条件下水电离程度的认识,同时考查学生思维的严密性。先分析pH=12的溶液中c(H+)、c(OH-)的大小。由c(H+)=10-pH得:
c(H+)=1.0×10-12 mol·L-1
c(OH-)=1.0×10-2 mol·L-1
再考虑溶液中的溶质:可能是碱,也可能是强碱弱酸盐。
最后进行讨论:
(1)若溶质为碱,则溶液中的H+都是水电离生成的:
c水(OH-)=c水(H+)=1.0×10-12 mol·L-1
(2)若溶质为强碱弱酸盐,则溶液中的OH-都是水电离生成的:
c水(OH-)=1.0×10-2 mol·L-1
本题难度:一般